Natriumselenat
Natriumselenat ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Selenate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
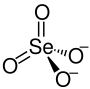 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumselenat | |||||||||||||||
| Andere Namen |
Dinatriumtetraoxoselenat(IV) | |||||||||||||||
| Summenformel | Na2SeO4 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 188,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,213 g·cm−3 (17 °C)[1] | |||||||||||||||
| Löslichkeit |
585 g·l−1 bei 25 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Natriumselenat kann durch Reaktion einer Selensäure-Lösung mit Natriumcarbonat gewonnen werden.[4]
Eigenschaften
Natriumselenat ist ein nicht brennbarer, hygroskopischer, weißer, geruchloser Feststoff, der sehr leicht löslich in Wasser ist.[1] Es kristallisiert orthorhombisch, Raumgruppe Fddd (Raumgruppen-Nr. 70), mit den Gitterparametern a = 6,099 Å, b = 12,59 Å, c = 10,16 Å.[5]
Verwendung
Natriumselenat wird als Insektizid und als Zusatz von Düngemitteln verwendet.[1][6] Es wird in geringer Dosis auch als Nahrungsergänzungsmittel und in der Medizin verwendet.[7][8][9]
Einzelnachweise
- Eintrag zu Natriumselenat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-91.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Januar 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 425.
- A. Kalman, D.W.J. Cruickshank: A note on the structure of Na2SeO4. In: Acta Crystallographica, B26, 1970, S. 436, doi:10.1107/S0567740870002534.
- Ralf Steudel: Chemie der Nichtmetalle: Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 3-11-021128-9, S. 468 (eingeschränkte Vorschau in der Google-Buchsuche).
- Klaus Karl Degitz, Hanns-Jürgen Krauß: Pathogenese, Klinik und Pharmakotherapie der Akne. Govi-Verlag Eschborn, 2004, ISBN 3-7741-1021-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- Frank Wappler, Gerald Spilker: Verbrennungsmedizin: Vom Unfallort bis zur Rehabilitation. Georg Thieme Verlag, 2008, ISBN 3-13-159531-0, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche).
- Irmgard Niestroj: Praxis der Orthomolekularen Medizin: Physiologische Grundlagen. Therapie mit ... Georg Thieme Verlag, 2000, ISBN 3-7773-1470-6, S. 480 (eingeschränkte Vorschau in der Google-Buchsuche).


