Nicotinamidadenindinukleotidphosphat
Nicotinamidadenindinukleotidphosphat, eigentlich Nicotinsäureamid-Adenin-Dinukleotid-Phosphat, abgekürzt NADP, ist ein Hydridionen-übertragendes (H− = Ein-Proton/Zwei-Elektronen) Koenzym, das an zahlreichen Redoxreaktionen des Stoffwechsels der Zelle beteiligt ist.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
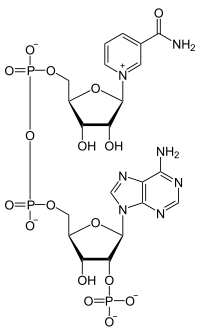 | ||||||||||||||||
| NADP+ (oxidierte Form) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nicotinamidadenindinukleotidphosphat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C21H29N7O17P3 | |||||||||||||||
| Kurzbeschreibung |
farbloser, hygroskopischer, amorpher Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 744,41 g·mol−1 | |||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Von der IUPAC/IUBMB werden die Abkürzungen NADP+ für die oxidierte Form, NADPH für die reduzierte Form und NADP im Allgemeinen vorgeschlagen.
Das Coenzym wurde 1931 von Otto Warburg entdeckt und war in der älteren Fachliteratur bis zu den frühen 1960er-Jahren auch unter der Bezeichnung Triphosphopyridinnucleotid, abgekürzt TPN, oder unter den Namen Codehydrase II bzw. Codehydrogenase II oder Coenzym II bekannt.[1]
NADPH ist ein Derivat des NADH, nämlich die (am Riboseteil, C2') phosphorylierte Form des Coenzyms NADH. Obwohl sich beide Coenzyme kaum unterscheiden, ist NADH primär mit Reaktionen im Katabolismus (etwa Glykolyse oder Citratzyklus) assoziiert, während NADPH als Reduktionsmittel im Anabolismus dient.[3] Diese "Aufgabenverteilung" ist auf die unterschiedlichen Konzentrationsverhältnisse zwischen oxidierter und reduzierter Form zurückzuführen[4]. Für NADPH überwiegt die reduzierte Form, was laut Nernst-Gleichung das Reduktionspotenzial mehr ins Negative verschiebt. Bei NADH ist es genau umgekehrt – dort überwiegt die oxidierte Form, NAD+. Durch zwei Coenzyme mit unterschiedlichen Reduktionspotenzialen innerhalb der Zelle können Oxidations- und Reduktionsreaktionen nebeneinander stattfinden.
NADPH dient in der reduzierenden Biosynthese als Lieferant von Elektronen und Protonen:
- bei der Synthese von Fettsäuren wird NADPH durch die Fettsäuresynthase zu NADP+ oxidiert.
- beim Abbau von mehrfach ungesättigten Fettsäuren wird NADPH zu NADP+ oxidiert (Enzym: 2,4-Dienoyl-CoA-Reduktase).
- im sogenannten Polyolweg, d. h. bei der Reduktion von Glucose zu Sorbitol, wird NADPH durch eine Reduktase zu NADP+ oxidiert.
- bei der Reduktion von Fettsäuren zum korrespondierenden Fettalkohol wird NADPH durch eine Acyl-CoA-Reduktase zu NADP+ oxidiert.
- eine Quelle von NADPH ist die direkte Oxidation von Glucose-6-phosphat (G-6P) durch Glucose-6-phosphat-Dehydrogenase (G-6P-DH) im Pentosephosphatweg. Die Messung der Menge an NADPH erlaubt eine genaue Bestimmung der Menge des bei der Glucose-6-phosphat-Dehydrogenase umgesetzten Zuckers, die NADPH-Molmenge ist exakt proportional zur Zucker-Molmenge. Im weiteren Verlauf entsteht durch die 6-Phosphogluconat-Dehydrogenase ein weiteres Molekül NADPH.
- Die NAD(P)H abhängige Glutamatdehydrogenase reduziert im Verlauf des Aminosäureabbaus NAD zu NADH.
- Bei grünen Pflanzen wird im Zuge der Photosynthese NADPH gebildet.
- Im Citrat-Shuttle wird NADPH bei der oxidativen Decarboxylierung von Oxalacetat gebildet, was ein NADP-abhängiges Malatenzym katalysiert.
Das Reduktionsvermögen von NADPH kann auf Glutathion übertragen werden.
Einzelnachweise
- Eintrag zu Nicotinamid-Adenin-Dinucleotid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juli 2014.
- Datenblatt β-Nicotinamide adenine dinucleotide phosphate hydrate bei Sigma-Aldrich, abgerufen am 16. April 2011 (PDF).
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter: Catalysis and the Use of Energy by Cells. In: Molecular Biology of the Cell. 4th edition. Garland Science, 2002 (nih.gov [abgerufen am 13. August 2023]).
- Pavlos Stephanos Bekiaris, Steffen Klamt: Network-wide thermodynamic constraints shape NAD(P)H cofactor specificity of biochemical reactions. In: Nature Communications. Band 14, Nr. 1, 3. August 2023, S. 4660, doi:10.1038/s41467-023-40297-8.
