N-Methylidenanilin
N-Methylidenanilin oder N-Methylidenaminobenzen ist eine organische chemische Verbindung und zählt zu den einfachsten Azomethinen. Sie findet – wie auch das Dibenzalaceton und das Benzalanilin – Verwendung in der Organometallchemie, etwa als Ligand an Palladium, Titan und Platin sowie als Zwischenprodukt bei der Synthese des N-Methylanilin.[3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
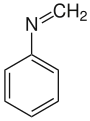 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N-Methylidenanilin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C7H7N | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 105,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Reaktivität
Das Molekül besitzt aufgrund der Doppelbindung und der reaktiven Methylidengruppe eine hohe Reaktivität (wie auch Benzalanilin) und kann mit vielen weiteren Verbindungen reagieren. Die polarisierte C=N-Doppelbindung ist somit ein guter Angriffspunkt für nucleophile und elektrophile Teilchen. Nucleophile greifen am Kohlenstoffatom der C=N-Doppelbindung an, Elektrophile hingegen am Stickstoffatom. Am Zeolith-Y-Katalysator kann die Substanz leicht zu N-Methylanilin hydriert werden.[3]
Eigenschaften
N-Methylidenanilin ist ein geruchloses, orange-rotes Pulver bestehend aus Mischkristallen. Die Substanz ist wasserunlöslich, löst sich teilweise in Chloroform und sehr gut in konzentrierter Schwefelsäure.
Darstellung
N-Methylidenanilin entsteht durch Kondensation von Anilin und Formaldehyd in Gegenwart von wasserabspaltenden Mitteln oder am Zeolith Y-Katalysator.[3] Dabei reagiert formal ein Äquivalent Formaldehyd mit einem Äquivalent Anilin zum N-Methylidenanilin.
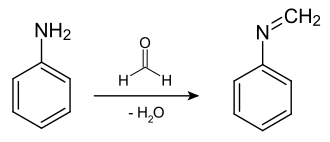
Im ersten Schritt greift das Stickstoffatom mit seinem freien Elektronenpaar die Carbonylgruppe (Aldehydgruppe) des Formaldehyds an. Aus dem doppelt gebundenen Sauerstoffatom der Carbonylgruppe wird ein negativ geladenes, einfachgebundenes Sauerstoffatom. Der Stickstoff gibt im nächsten Schritt sein Proton an das negativ geladene Sauerstoffatom ab – es entsteht eine Hydroxygruppe. Unter anschließender Wasserabspaltung entsteht dann das N-Methylidenanilin.

Einzelnachweise
- J. M. Patterson, C.-Y. Shiue, W. T. Smith Jr.: Benzonitrile formation in the pyrolysis of aromatic nitrogen compounds, in J. Org. Chem. 1973, 38, 2447–2450; doi:10.1021/jo00954a007.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- E. V. Steen (Hrsg.), C. Claeys (Hrsg.): Recent advances in the science and technology of zeolites and related materials: proceedings of the 14th International Zeolite Conference, Kapstadt, Südafrika, 25–30. April 2004, Part 3, Gulf Professional Publishing, 2004, ISBN 978-0-444-51825-5, S. 2221–2227.