N-Allylanilin
N-Allylanilin ist eine organische Verbindung. Sie besteht aus einem Anilingerüst, welches eine Allylgruppe am Stickstoffatom trägt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
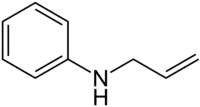 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | N-Allylanilin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H11N | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 133,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,98 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| pKS-Wert |
4,17 (25 °C)[4] | |||||||||||||||||||||
| Brechungsindex |
1,563 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Darstellung
N-Allylanilin kann durch Alkylierung von Anilin mit Allylchlorid[5], -bromid[6] oder -iodid[7] hergestellt werden. Auch die Synthese durch eine Ullmann-Aminierung aus Allylamin und Phenyliodid ist bekannt.[8]
Historisch führte N-Allylanilin zur Strukturaufklärung von Chinolin, welches 1880 unter Verwendung von Bleioxid aus N-Allylanilin synthetisiert werden konnte.[9]
Einzelnachweise
- Datenblatt N-Allylaniline bei Sigma-Aldrich, abgerufen am 12. April 2011 (PDF).
- Eintrag zu N-Allylaniline bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-12.
- W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- H. Oehme, R. Thamm: Synthese und Reaktionsverhalten der (3-Aminopropy1)-phenylphosphine. In: J. Prakt. Chem 315, 1973, S. 526–538; doi:10.1002/prac.19733150320.
- F. L. Carnahan, C. D. Hurd: Pyrolysis pf Allylanilines. In: J. Am. Chem. Soc. 52, 1930, S. 4586–4595; doi:10.1021/ja01374a062.
- V. Pace, F. Martinez, M. Fernandez, J. V. Sinisterra, A. R. Alcantara: Effective Monoallylation of Anilines Catalyzed by Supported KF. In: Org. Lett. 9, 2007, S. 2661–2664; doi:10.1021/ol070890o.
- D. Ma, Q. Cai, H. Zhang: Mild Method for Ullmann Coupling Reaction of Amines and Aryl Halides. In: Org. Lett. 5, 2003, S. 2453–2456; doi:10.1021/ol0346584.
- Wilhelm Koenigs: Synthese des Chinolins aus Allylanilin. In: Chem. Ber. 12, 1879, S. 453; doi:10.1002/cber.187901201128.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
