Monosilan
Monosilan ist der einfachste Vertreter der Silane (auch Siliciumwasserstoffe genannt) und somit das Siliciumanalogon von Methan, CH4. Es hat – im Gegensatz zu Methan – einen unangenehmen, abstoßenden Geruch.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
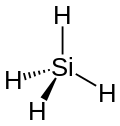 | ||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Monosilan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | SiH4 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 32,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−112 °C[2] | |||||||||||||||
| Löslichkeit |
rasche Hydrolyse in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,5 ml·m−3 bzw. 0,7 mg·m−3[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Monosilan kann im Labor durch Reaktion von Magnesiumsilicid mit Salzsäure hergestellt werden. Technische Herstellungsverfahren beruhen auf der Hydrierung von Siliciumtetrachlorid mit Lithiumhydrid im Lithiumchlorid/Kaliumchlorid-Eutektikum,[1]
bzw. auf der Dismutation von Hydrogenchlorsilanen, wie z. B. Trichlorsilan.[5]
Chemische Eigenschaften
Monosilan ist hoch entzündlich und pyrophor, d. h., Monosilan entzündet sich an der Luft selbst. Bei der Verbrennung entstehen Siliciumdioxid und Wasserdampf.
In Wasser bei einem pH-Wert oberhalb von 7 zersetzen sich Silane zu Kieselsäure und Wasserstoff:
- Monosilan und Wasser bilden Kieselsäure und Wasserstoff.
Unter Luft- und Feuchtigkeitsausschluss ist Monosilan bis ca. 300 °C stabil. Darüber tritt Zerfall in Silicium und Wasserstoff ein.
Durch Einwirkung von Halogenen oder Halogenwasserstoff in Gegenwart von Aluminiumchlorid lassen sich die Wasserstoffatome der Reihe nach ersetzen.[6]
Bei der Umsetzung von Monosilan mit Alkalimetallen z. B. in Ethylenglycoldimethylether bilden sich die Silylverbindungen der entsprechenden Metalle:[7]
Die UN-Nummer von Monosilan ist 2203, der Gefahrzettel 2.1.
Verwendung
Monosilan wird zur Abscheidung von Silicium-, Siliciumoxid- und Siliciumnitridschichten verwendet. Daher wird Monosilan hauptsächlich in der Halbleiterfertigung oder bei der Herstellung von Solarzellen eingesetzt.
Einzelnachweise
- Eintrag zu Silane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- Eintrag zu Monosilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7803-62-5 bzw. Monosilan), abgerufen am 2. November 2015.
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 68–69, ISBN 978-3-8348-1245-2.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3.
- Egon Wiberg: Lehrbuch der Anorganischen Chemie: Mit einem Anhang: Chemiegeschichte. Walter de Gruyter, 2011, ISBN 978-3-11-023832-7, S. 319–320 (eingeschränkte Vorschau in der Google-Buchsuche).
- Barry Arkles: Silanes. (PDF) Reprint from Kirk-Othmer Encyclopedia of Chemical Technology, Forth Edition, Volume 22, Page 38–69. In: Gelest. S. 53, abgerufen am 10. Dezember 2016 (englisch).

