Methylotrophe Mikroben
Methylotrophe Organismen (kurz Methylotrophe) sind eine vielfältige Gruppe von Mikroorganismen, die reduzierte Verbindungen mit einem (einzigen) Kohlenstoff-Atom (C1-Verbindungen) wie Methanol (CH3OH), Methan (CH4), Formiat oder Kohlenmonoxid (CO) als Kohlenstoffquelle für ihr Wachstum nutzen können (Assimilation). Dabei sind Verbindungen mit mehreren Kohlenstoff-Atomen eingeschlossen, wenn diese keine direkten Kohlenstoff-Kohlenstoff-Bindungen[A. 1] enthalten, wie beispielsweise Dimethylether (H3C-O-CH3 bzw. gleichwertig (CH3)2O) und Dimethylamin ((CH3)2NH). Mitglieder dieser Gruppe sind beispielsweise Mikroorganismen, die reduzierte Ein-Kohlenstoff-Verbindungen mit Hilfe von Kohlendioxid (CO2) über den Ribulose-Biphosphat-Weg (Calvin-Zyklus) zu assimilieren.[1][2][3]
Diese Organismen sind nicht mit den Methanogenen (Methanbildnern) zu verwechseln, die im Gegenteil Methan als Nebenprodukt aus verschiedenen Ein-Kohlenstoff-Verbindungen wie Kohlendioxid erzeugen. Einige methylotrophe Organismen können das Treibhausgas Methan dagegen abbauen und werden in diesem speziellen Fall auch als methanotrophe Organismen bezeichnet.[4]
Wegen der Menge, der Reinheit und des niedrigen Preises des zur Verfügung stehenden Methanols sind Methanol-verwertende Methylotrophe beispielsweise ideale Organismen für die Produktion von Aminosäuren, Vitaminen, Einzellerproteinen (englisch single cell proteins), rekombinanter Proteine (englisch recombinant proteins),[A. 2] Coenzymen und Cytochromen. Sie könne daher sogar besser geeignet als die üblicherweise verwendeten Zellkulturen, die mit Zuckern „gefüttert“ werden.
Stoffwechsel

Das wichtigste Zwischenprodukt des methylotrophen Stoffwechsels ist Formaldehyd, über das entweder in assimilatorische oder dissimilatorische Stoffwechselwege geleitet werden können.[5] Methylotrophe produzieren Formaldehyd durch Oxidation von Methanol und/oder Methan. Für die Methanoxidation ist das Enzym Methan-Monooxygenase (MMO) erforderlich.[6][7] Methylotrophe Organismen mit diesem Enzym werden als Methanotrophe bezeichnet.[4] Die Oxidation von Methan (oder Methanol) kann assimilatorisch oder dissimilatorisch (katabolisch) erfolgen (siehe Abbildung). Im Falle der dissimilatorischen Oxidation wird das Formaldehyd-Zwischenprodukt vollständig oxidiert zu CO2, wobei ein Reduktionsmittel und Energie frei werden.[8][9] Bei der assimilatorischen Oxidation wird das Formaldehyd-Zwischenprodukt für die Synthese einer Dreifach-Kohlenstoff-Verbindung (C3-Verbindung) benutzt, mit deren Hilfe dann die Produktion von Biomasse erfolgt.[5][10] Viele Methylotrophe verwenden Multikohlenstoffverbindungen (Cn) für den Aufbau von körpereigenen Stoffen Anabolismus und beschränken ihre Verwendung von Formaldehyd auf dissimilatorische Prozesse, während im Spezialfall der Methanotrophen diese sich im Allgemeinen auf den C1-Stoffwechsel beschränken.[5][8]
| Ein-Kohlenstoff-Verbindungen (C1) | Chemische Formel | Mehrfach-Kohlenstoff-Verbindungen (Cn) | Chemische Formel |
|---|---|---|---|
| Kohlenmonoxid | Dimethylether (DME) | ||
| Formaldehyd | Dimethylamin | ||
| Formamid | Dimethylsulfid (DMS) | ||
| Ameisensäure (Formiat) | Tetramethylammonium[15] | ||
| Methan | Trimethylamin | ||
| Methanol | Trimethylamin-N-Oxid | ||
| Methylamin | Trimethylsulfonium[16] | ||
| Halogenmethane |
Katabolismus
Methylotrophe Organismen nutzen die Elektronentransportkette, um Energie aus der Oxidation von C1-Verbindungen zu gewinnen. Um den Abbau des chemisch stabilem Methans zu ermöglichen ist im methanotrophen Stoffwechsel ist ein zusätzlicher Aktivierungsschritt erforderlich. Die Oxidation zu Methanol wird durch die Methan-Monooxygenase (MMO) katalysiert, die ein Sauerstoffatom aus O2 ins Methanmolekül einbaut und das andere Sauerstoffatom zu Wasser (H2O) reduziert.[7][8] Methanol wird dann in Bakterien durch die Methanol-Dehydrogenase (MDH)[17] oder in Hefe durch eine unspezifische Alkoholoxidase[18] zu Formaldehyd oxidiert. Die Elektronen aus der Methanoloxidation werden an ein membranassoziiertes Chinon der Elektronentransportkette weitergeleitet, wodurch die Energie in Form von Adenosintriphosphat (ATP) gewonnen wird.[19]
Bei dissimilatorischen Prozessen wird Formaldehyd vollständig zu CO2 oxidiert und ausgeschieden. Formaldehyd wird durch die Wirkung der Formaldehyd-Dehydrogenase (FALDH) zu Formiat oxidiert und das Elektronen direkt an ein membranassoziiertes Chinon der Elektronentransportkette abgibt (in der Regel Cytochrom b oder c).[5][8] Im Falle von NAD+-assoziierten Dehydrogenasen wird NADH gebildet.[10]
Schließlich wird das Formiat zu CO2 oxidiert durch eine zytoplasmatische (lösliche) oder membrangebundene Formiat-Dehydrogenase (FDH) oxidiert, wodurch NADH und CO2 produziert werden.[20]
Anabolismus
Die wichtigste Herausforderung für den Stoffwechsel der Methylotrophen ist die Assimilation von C1-Molekülen zu Biomasse. Die Methylotrophen müssen dazu de novo Kohlenstoff-Kohlenstoff-Bindungen zwischen den bisherigen C1-Molekülen bilden. Fakultativ Methylotrophe vermeiden diesen energieintensiven Prozess, indem sie – wenn möglich – eine Reihe größerer organischer Verbindungen benutzen.[21] Obligat Methylotrophe müssen jedoch die C1-Moleküle assimilieren.[5][8] Eine Zwischenstellung nehmen sog. eingeschränkt fakultativ Methylotrophe (englisch restricted facultative methylotrophs) ein, die außer C1-Verbindungen lediglich eine begrenzte Anzahl komplexerer organischer Verbindungen nutzen können. Zu dieser Gruppe gehören Vertreter der Bakteriengattungen Hansschlegelia[22] und Methylobrevis[23][24] (beide zu Ordnung Hyphomicrobiales der Alphaproteobakterien) sowie Methylovorus[25][26] (Ordnung Nitrosomonadales der Betaproteobakterien).[A. 3]
Es gibt insgesamt vier verschiedene Assimilationswege, die der Biosynthese eines C3-Moleküls dienen.[5] Alle vier Wege bauen drei C1-Moleküle in Multi-Kohlenstoff-Zwischenprodukte ein, und spalten dann von einem Zwischenprodukt ein neues C3-Molekül ab. Die verbliebenen Reste der Zwischenprodukte werden anschließend umgeordnet, um die ursprünglichen Multi-Kohlenstoff-Zwischenprodukte zu regenerieren.
Bakterien nutzen drei dieser Wege,[10][14] während Pilze (Hefen) nur einen nutzen.
- Jede Spezies methylotropher Bakterien hat unter diesen drei bakteriellen einen spezifischen dominanten Assimilationsweg.[8] Die drei charakterisierten Wege für die Kohlenstoffassimilation sind bei der Formaldehydassimilation der Ribulosemonophosphatweg (RuMP, Typ I), der Serinweg (Typ II) sowie für die CO2-Assimilation der Ribulosebiphosphatweg (RuBP, alias Calvin-Benson-Bassham-Zyklus, CBB).[5][10][14][29]
- Der Stoffwechsel der methylotrophen Hefepilze[A. 5] unterscheidet sich von dem der Bakterien vor allem durch die verwendeten Enzyme und den Weg der Kohlenstoffassimilation.
Während Bakterien zur Oxidation von Methanol eine bakterielle Methanoldehydrogenase (MDH, EC 1.1.3.7[33]) nutzen, oxidieren methylotrophe Hefen Methanol in ihren Peroxisomen mit einer unspezifischen Alkoholoxidase (AOX[34]). Dabei entstehen sowohl Formaldehyd als auch Wasserstoffperoxid (H2O2).[31][35] Durch die Kompartimentierung dieser Reaktion in den Peroxisomen wird wahrscheinlich das entstehende Wasserstoffperoxid sequestriert. In den Peroxisomen wird Katalase produziert, um dieses schädliche Nebenprodukt zu beseitigen.[36][31]
Bakterien: Ribulosebiphosphatweg (RuBP)

Im Gegensatz zu den anderen Assimilationswegen beziehen Bakterien, die den RuBP-Weg nutzen, ihren gesamten organischen Kohlenstoff durch CO2-Assimilation.[8][37] Dieser Stoffwechselweg wurde zuerst bei photosynthetischen Autotrophen[A. 6] aufgeklärt und ist besser bekannt als Calvin-Zyklus.[37][38] Kurz darauf wurden methylotrophe Bakterien gefunden, die auf reduzierten C1-Verbindungen wachsen können und diesen Stoffwechselweg nutzen.[39]
Zunächst werden drei Moleküle Ribulose-5-phosphat zu Ribulose-1,5-bisphosphat (RuBP, auch RuP2) phosphoryliert.[A. 7] Das Enzym Ribulosebisphosphatcarboxylase (RuBisCO) carboxyliert die RuBP-Moleküle, wodurch sechs Moleküle 3-Phosphoglycerat (PGA, auch 3-PG) entstehen. Das Enzym Phosphoglyceratkinase phosphoryliert PGA zu 1,3-Diphosphoglycerat (DPGA). Bei der Reduktion von sechs DPGA durch das Enzym Glyceraldehydphosphat-Dehydrogenase (GADPH) entstehen sechs Moleküle der C3-Verbindung Glyceraldehyd-3-phosphat (GAP oder G3P[34]). Ein GAP-Molekül wird in die Biomasse umgeleitet, während die anderen fünf Moleküle zuletzt die drei Moleküle von Ribulose-5-Phosphat regenerieren, die im nächsten Durchlauf des Zyklus wieder zu RuBP phosphoryliert werden.[10][38]
Bakterien: Ribulosemonophosphatweg (RuMP)

Als in dem methanotrophen Gammaproteobakterium Methylomonas methanica (Methylococcaceae)[40] kein RuBisCO gefunden wurde, vermutete man bereits 1980 einen neuen Stoffwechselweg.[41] Mit Hilfe der Isotopenmarkierung konnte dann 1996 gezeigt werden, dass M. methanica den Ribulosemonophosphatweg (RuMP, auch Hexulosephosphatzyklus genannt) nutzt. Die Entdeckung veranlasste die Autoren zudem zu der These, dass der RuMP-Weg dem RuBP-Weg entwicklungsgeschichtlich (in der Evolution) vorausgegangen sein könnte.[8]
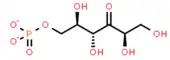
Wie der RuBP-Weg beginnt auch dieser Stoffwechselweg mit 3 Molekülen Ribulose-5-phosphat. Aber anstatt das Ribulose-5-phosphat zu phosphorylieren, bilden hier jedoch 3 Moleküle Formaldehyd durch eine Aldolkondensation eine C-C-Bindung, wodurch 3 C6-Moleküle von D-Arabino-3-Hexulose-6-phosphat (HU6P,[34] Hexulosephosphat, CAS 53010-97-2[42][43][44]), vermittelt durch eine Hexulose-6-phosphat-Synthase (HPS[34]) entstehen.[9][41][45] Diese Reaktion wird durch eine Hexulosephosphat-Synthase (HPS)[34][46] katalysiert.
Eines dieser Hexulosephosphat-Moleküle wird in Glycerinaldehyd-3-phosphat (GAP, auch G3P) und entweder in Pyruvat (Brenztraubensäure) oder Dihydroxyacetonphosphat (DHAP) umgewandelt. Das Pyruvat oder DHAP wird für die Produktion der Biomasse verwendet, während die anderen beiden Hexulosephosphat-Moleküle und das GAP-Molekül zur Regeneration der drei Ribulose-5-phosphat-Moleküle verwendet werden.[9][41]
Bakterien: Serinweg

Im Gegensatz zu den anderen Assimilationswegen werden beim Serinweg (Serinzyklus) anstelle von Kohlenhydraten Carbonsäuren und Aminosäuren als Zwischenprodukte verwendet.[8][47] Zunächst werden zwei Moleküle Formaldehyd zu zwei Molekülen der Aminosäure Glycin hinzugefügt. Dadurch entstehen zwei Moleküle der Aminosäure Serin, dem wichtigsten Zwischenprodukt dieses Stoffwechselwegs. Aus diesen Serinmolekülen entstehen schließlich zwei Moleküle 2-Phosphoglycerat (2-Phosphoglycerinsäure), wobei ein C3-Molekül in die Biomasse geht und das andere zur Regeneration von Glycin verwendet wird. Wichtig ist: Für die Regeneration von Glycin wird zusätzlich ein Molekül CO2 benötigt. Daher unterscheidet sich der Serin-Weg auch von den anderen drei Wegen durch seinen Bedarf an Formaldehyd und CO2.[41][47]
Hefen: Dihydroxyacetonweg (DHA)
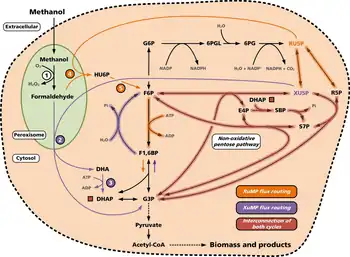
Der Dihydroxyacetonweg (Dihydroxyacetonzyklus, DHA-Weg), auch als Xylulosemonophosphatweg (XuMP-Weg) bezeichnet, kommt ausschließlich in Hefen vor.[31][48] Bei diesem Stoffwechselweg werden drei Moleküle Formaldehyd zu einem Molekül Dihydroxyacetonphosphat (DHAP) assimiliert, wobei drei Moleküle Xylulose-5-Phosphat (XU5P)[34][49] als Schlüsselzwischenprodukt Verwendung finden. Die DHA-Synthase wirkt als Transferase (genauer: Transketolase), um einen Teil des Xylulose-5-Phosphats auf Dihydroxyaceton (DHA) zu übertragen. Anschließend werden diese drei DHA-Moleküle von der Triokinase zu DHAP phosphoryliert. Wie bei den anderen Zyklen werden drei C3-Moleküle synthetisiert, wobei eines dieser Moleküle für die Verwendung als Zellmaterial (Biomasse) bestimmt ist. Die beiden anderen Moleküle werden für die Regeneration von Xylulose-5-Phosphat verwendet.[50]
Bedeutung für die Umwelt und Anwendungen
Nahrungskreisläufe und Klima
Als wichtige Akteure im Kohlenstoffkreislauf tragen Methylotrophe vor allem durch die Aufnahme von Methan und anderen Treibhausgasen (wie Methan und CO2) zur Verringerung der globalen Erwärmung bei. In wässrigem Milieu produzieren methanogene Mikroorganismen 40–50 % des weltweit produzierten Methans. Durch die Symbiose (siehe Vergesellschaftung (Biologie) §Mikroben) zwischen methanogenen und methanotrophen Bakterien wird die Menge des in die Atmosphäre freigesetzten Methans erheblich verringert.[51]
Diese Symbiose ist auch in marinen Umgebungen von großer Bedeutung. Marine Bakterien sind sehr wichtig für die Nahrungskette (englisch auch food web genannt) und biogeochemische Stoffkreisläufe. Dies gilt insbesondere für küstennahe Oberflächengewässer, aber auch für anderen wichtigen Ökosysteme wie hydrothermale Schloten. Es werden weit verbreitete und vielfältige Gruppen von Methylotrophen im Ozean vermutet, mit dem Potenzial, die Ökosysteme der Meere und Flussmündungen erheblich zu beeinflussen.[52] Ein-Kohlenstoff-Verbindungen (C1-Verbindungen), die von Methylotrophen als Quelle von Biomasse und Energie genutzt werden, finden sich überall im Ozean. Zu diesen Verbindungen gehören Methan (bzw. Methanhydrat), Methanol, methylierte Amine, Methylhalogenide und methylierte Schwefelverbindungen wie Dimethylsulfid (DMS, H3C-S-CH3) und Dimethylsulfoxid (DMSO, (CH3)2S).[53] Einige dieser Verbindungen werden vom Phytoplankton produziert, andere stammen aus der Atmosphäre. Studien, die ein breiteres Spektrum von Ein-Kohlenstoff-Substraten (C1-Substraten) einbeziehen, haben eine zunehmende Vielfalt von Methylotrophen festgestellt, ein Umstand, der darauf hindeutet, dass die Vielfalt dieser Gruppe von Bakterien (und anderen Mikroben) bei weitem noch nicht vollständig erforscht ist.[53]
Da diese Verbindungen flüchtig sind und sich auf das Klima und die Atmosphäre auswirken, kann die Erforschung der Interaktion dieser Organismen mit den C1-Verbindungen auch zum Verständnis des Austausches zwischen der Atmosphäre und dem Ozean beitragen – und welchen Einfluss dieser auf das Klima hat, wichtig für Klimavorhersagen.[54][52] Es ist beispielsweise derzeit (Stand 2018) ungewiss, ob der Ozean als Nettoquelle oder -senke für atmosphärisches Methanol fungiert, während eine Reihe von Methylotrophen Methanol als ihre Hauptenergiequelle nutzt. In einigen Regionen haben sich Methylotrophe als Netto-Senke für Methanol erwiesen,[55] während in anderen Regionen Methylamin (CH3N-H2) als ein Produkt der Aktivität von Methylotrophen aus dem Ozean emittiert wird und Aerosole bildet.[52] Die Nettorichtung dieser Ströme hängt von der genauen Nutzung durch die verschiedenen Methylotrophen ab.
Untersuchungen haben ergeben, dass die Auswirkungen der Methylotrophie wahrscheinlich saisonal schwanken, denn die methylotrophe Kapazität geht einher mit der Produktivität eines Systems. Da einige der von Methylotrophen verstoffwechselten C1-Verbindungen wie Methanol und Trimethylaminoxid (TMAO) von Phytoplankton produziert werden, schwankt ihre Verfügbarkeit zeitlich und saisonal in Abhängigkeit von Phytoplanktonblüten, Wetterereignissen und anderen Einträgen (Inputs) in das Ökosystem.[56] Dies bedeutet, dass der methylotrophe Stoffwechsel insgesamt voraussichtlich einer ähnlichen Dynamik folgt, was sich wiederum auf die biogeochemischen Zyklen (Stoffkreislauf) wie Kohlenstoffflüsse auswirkt.[52]
Auch in hydrothermalen Schloten der Tiefsee wurde die Bedeutung von Methylotrophen untersucht. Methylotrophe Mikroorganismen exprimierten zusammen mit Schwefeloxidierern und Eisenoxidierern Schlüsselproteine, die mit der Kohlenstofffixierung in Verbindung stehen.[57] Solche Studien können zum weiteren Verständnis des Kohlenstoffkreislaufs sowohl in der Tiefsee selbst als auch der Zusammenhänge zwischen dem Kohlenstoffkreislauf in der Tiefsee und an der Oberfläche beitragen. In der letzten Zeit hat die Ausweitung der „omik“-Technologien (Genomik, Metagenomik, Proteomik, Transkriptomik etc.) die Erforschung der Methylotrophen bzgl. ihrer Vielfalt, ihre Häufigkeit und ihrer Aktivität in einer Vielzahl von Umweltnischen beschleunigt, wozu auch die Interaktionen zwischen verschiedenen Arten gehört, die sich einen Lebensraum (Habitat) teilen.[58] Weitere Forschungen über diese Mikroben und die Gesamtwirkung des mikrobiellen Abbaus einerseits wie der Umwandlung von C1-Verbindungen im Ozean andererseits sind noch durchzuführen. Derzeitige Erkenntnisse deuten darauf hin, dass die Methylotrophen im Ozean eine potenziell wichtige Rolle nicht nur im Kohlenstoffkreislauf spielen, sondern auch im globalen Stickstoff-, Schwefel- und Phosphorkreislauf, sowie im Austausch von Kohlenstoffverbindungen zwischen Luft und Meer (englisch air-sea flux), insbesondere im Hinblick auf Auswirkungen auf das globale Klima.[54]
Anwendungen
Die Verwendung von Methylotrophen in der Landwirtschaft ist eine weitere Möglichkeit potenzieller Auswirkungen auf die Umwelt. Herkömmliche chemische Düngemittel liefern zwar Nährstoffe, die im Boden nicht oder nicht ausreichend verfügbar sind, können jedoch negative Auswirkungen auf die Umwelt haben und sind in der Herstellung teuer.[59] Methylotrophe haben ein großes Potenzial als alternative Biodünger und Bioinokulantien,[A. 8] da sie in der Lage sind, mutualistische Beziehungen mit verschiedenen Pflanzenarten einzugehen.[60] Methylotrophe Pflanzen versorgen die Pflanzen mit Nährstoffen wie löslichem Phosphor und gebundenem Stickstoff und spielen auch eine Rolle bei der Aufnahme der genannten Nährstoffe.[59][60] Darüber hinaus können sie Pflanzen durch die Produktion von Phytohormonen dabei helfen, auf Umweltstressoren zu reagieren.[59] Methylotrophes Wachstum hemmt zudem das Wachstum schädlicher Pflanzenpathogene und führt zu systemischer Resistenz.[60] Methylotrophe Hefen (Ogataea polymorpha syn. Hansenula polymorpha) lassen sich seit dem Jahr 2000 zur Reinigung von Schmutzwasser einsetzen.[34] Methylotrophe Biodünger, die entweder allein oder zusammen mit chemischen Düngemitteln verwendet werden, erhöhen nachweislich sowohl den Ertrag als auch die Qualität der Pflanzen, ohne dass Nährstoffe verloren gehen.[59] Eine nachhaltige Produktion von Kraftstoffen (z. B. Isopentanol) und anderen Chemikalien durch Gentechnisch veränderte methylotrophe Hefen wurde 2022 von Vanessa Wegat et al. untersucht, insbesondere im Hinblick auf das angestrebte 1,5-Grad-Ziel für die globale Erwärmung. In dieser Studie wurden insbesondere auch neue, synthetische methylotrophe Stoffwechselwege in Betracht gezogen.[34]
Anmerkungen
- Kohlenstoff-Kohlenstoff-Bindungen: Kovalente Bindungen C–C, C=C oder C≡C.
- Einzellerproteine versus rekombinante Proteine: Erstere werden durch natürlich vorkommende Einzeller synthetisiert, letztere sind durch gentechnisch veränderten Organismen erzeugt, inklusive solcher, in die zusätzliche DNA-Moleküle (etwa als Plasmide) eingeschleust wurden
- Die Bezeichnungsweise ist etwas irreführend. Der Begriff „eingeschränkt“ (englisch restricted) zusammen mit „fakultativ“ bezieht sich auf die Methylotrophie dieser Mikroben und bedeutet, dass sie sich nicht zwingend methylotroph ernähren müssen. Es handelt sich also tatsächlich um eine Erweiterung des Spektrums an nutzbaren Verbindungen. Beispielsweise nutzt die eingeschränkt fakultativ heterotrophe Hansschlegelia plantiphila je nach Stamm neben den C1-Verbindungen Methanol, Methylamin bzw. Formiat (Ameisensäure)[27] zusätzlich noch Glycerin, Inulin, Succinat (Bernsteinsäure), Fumarat (Fumarsäure) und/oder Acetat (Essigsäure).[28] Von der Gattung Methylobrevis ist die Art Methylobrevis pamukkalensis[23] als eingeschränkt fakultativ methylotroph bekannt.[24]
- wie z. B. Komagataella phaffii
- Nach Yurimoto (2011) sind als Gattungen methylotropher Hefen bekannt: Candida, Pichia, Ogataea,[30] Kuraishia und Komagataella;[A. 4] alle in der Ordnung Saccharomycetales (Echte Hefen).[31][32]
- Organismen, die ihre Baustoffe (und organischen Reservestoffe) ausschließlich aus anorganischen Stoffen aufzubauen und die Energie dazu aus dem (Sonnen-)Licht beziehen.
- Je nach Darstellung kann dieser Schritt auch als letzter Regenerationsschritt dargestellt werden.
- Bioinokulantien, auch Mikrobielle Inokulantien oder Bodeninokulantien genannt, sind landwirtschaftliche Zusatzstoffe, die nützliche rhizosphärische (Knöllchenbakterien im weiteren Sinn) oder endophytische (im Innern der Pflanzen lebende) Mikroben zur Förderung der Pflanzengesundheit einsetzen.
Einzelnachweise
- C. Anthony: The biochemistry of methylotrophic micro-organisms. In: Science Progress, Band 62, Nr. 246, Oxford, Sommer 1975, S. 167–206; JSTOR:43420299, PMID 810884.
-
C. Anthony: The Biochemistry of Methylotrophs. In: Academic Press, London, New York, 1. Juni 1982, Band 160, Nr. 1–2, August 1983, S. 2–3; PDF. Dazu:
- P. H. Clark: Vorwort, doi:10.1016/0014-5793(83)80989-2.
- Review Comparative Biochemistry and Physiology Part A: Physiology, Band 75, Nr. 3, 1983, Page 497; doi:10.1016/0300-9629(83)90116-0.
- Methylotrophe. Kompaktlexikon der Biologie; auf: spektrum.de.
- Methanotrophe. Kompaktlexikon der Biologie; auf: spektrum.de.
- Hiroya Yurimoto, Nobuo Kato, Yasuyoshi Sakai: Assimilation, dissimilation, and detoxification of formaldehyde, a central metabolic intermediate of methylotrophic metabolism. In: The Chemical Record. 5. Jahrgang, Nr. 6, 1. Januar 2005, ISSN 1528-0691, S. 367–375, doi:10.1002/tcr.20056, PMID 16278835 (englisch).
- Ngoc-Loi Nguyen, Woon-Jong Yu, Hye-Young Yang, Jong-Geol Kim, Man-Young Jung, Soo-Je Park, Seong-Woon Roh, Sung-Keun Rhee: A novel methanotroph in the genus Methylomonas that contains a distinct clade of soluble methane monooxygenase. In: Journal of Microbiology. 55. Jahrgang, Nr. 10, 28. September 2017, S. 775–782, doi:10.1007/s12275-017-7317-3, PMID 28956349 (englisch).
- Matthew O. Ross, Amy C. Rosenzweig: A tale of two methane monooxygenases. In: Journal of Biological Inorganic Chemistry. 22. Jahrgang, Nr. 2–3, 1. April 2017, ISSN 0949-8257, S. 307–319, doi:10.1007/s00775-016-1419-y, PMID 27878395, PMC 5352483 (freier Volltext) – (englisch).
- R. S. H. Hanson, Thomas E. Hanson: Methanotrophic bacteria. In: Microbiological Reviews. 60. Jahrgang, Nr. 2, 1. Juni 1996, ISSN 1092-2172, S. 439–471, doi:10.1128/mr.60.2.439-471.1996, PMID 8801441, PMC 239451 (freier Volltext) – (englisch). ResearchGate.
- Julia A. Vorholt: Cofactor-dependent pathways of formaldehyde oxidation in methylotrophic bacteria. In: Archives of Microbiology. 178. Jahrgang, Nr. 4, 1. Oktober 2002, ISSN 0302-8933, S. 239–249, doi:10.1007/s00203-002-0450-2, PMID 12209256 (englisch).
- J. Colby, H. Dalton, Whittenbury, R.: Biological and Biochemical Aspects of Microbial Growth on C1 Compounds. In: Annual Review of Microbiology. 33. Jahrgang, Nr. 1, 1979, S. 481–517, doi:10.1146/annurev.mi.33.100179.002405, PMID 386931 (englisch).
- Ronald S. Oremland, Ronald P. Kiene, Indra Mathrani, Michael J. Whiticar, David R. Boone: Description of an Estuarine Methylotrophic Methanogen Which Grows on Dimethyl Sulfide. In: Applied and Environmental Microbiology. 55. Jahrgang, Nr. 4, 1. April 1989, ISSN 0099-2240, S. 994–1002, doi:10.1128/AEM.55.4.994-1002.1989, PMID 16347900, PMC 184236 (freier Volltext), bibcode:1989ApEnM..55..994O (englisch).
- Andrew J. Holmes, D. P. Kelly, Simon C. Baker, A. S. Thompson, Paolo De Marco, Elizabeth M. Kenna, J. Colin Murrell: Methylosulfonomonas methylovora gen. nov., sp. nov., and Marinosulfonomonas methylotropha gen. nov., sp. nov.: novel methylotrophs able to grow on methanesulfonic acid. In: Archives of Microbiology, Band 167, Nr. 1, 1. Januar 1997, ISSN 0302-8933, S. 46–53; doi:10.1007/s002030050415, PMID 9000341.
- Don P. Kelly, Simon C. Baker, Jim Trickett, Margaret Davey, J. Colin Murrell: Methanesulphonate utilization by a novel methylotrophic bacterium involves an unusual monooxygenase. In: Microbiology. 140. Jahrgang, Nr. 6, 1. Juni 1994, S. 1419–1426, doi:10.1099/00221287-140-6-1419 (englisch).
- Julia Firsova, Nina Doronina, Elke Lang, Cathrin Spröer, Stéphane Vuilleumier, Yuri Trotsenko: Ancylobacter dichloromethanicus sp. nov. – a new aerobic facultatively methylotrophic bacterium utilizing dichloromethane. In: Systematic and Applied Microbiology, Band 32, Nr. 4, Juli 2009, S. 227–232; doi:10.1016/j.syapm.2009.02.002, PMID 19346095.
- CAS 51-92-3. Tetramethylammonium. Auf: Chemical Abstracts Service.
- CAS 676-84-6. Trimethylsulfonium. Auf: Chemical Abstracts Service.
- J. A. Duine, J. Frank, M. P. J. Berkhout: NAD-dependent, PQQ-containing methanol dehydrogenase: a bacterial dehydrogenase in a multienzyme complex. In: FEBS Letters. 168. Jahrgang, Nr. 2, 26. März 1984, ISSN 1873-3468, S. 217–221, doi:10.1016/0014-5793(84)80249-5, PMID 6373362 (englisch).
- William D. Murray, Sheldon J. B. Duff, Patricia H. Lanthier: Induction and stability of alcohol oxidase in the methylotrophic yeast Pichia pastoris. In: Applied Microbiology and Biotechnology. 32. Jahrgang, Nr. 1, 1. November 1989, ISSN 0175-7598, S. 95–100, doi:10.1007/BF00164829 (englisch).
- H. W. Van Verseveld, A. H. Stouthamer: Electron-transport chain and coupled oxidative phosphorylation in methanol-grown Paracoccus denitrificans. In: Archives of Microbiology. 118. Jahrgang, Nr. 1, 1. Juli 1978, ISSN 0302-8933, S. 13–20, doi:10.1007/BF00406068, PMID 29587 (englisch).
- Ludmila Chistoserdova, Gregory J. Crowther, Julia A. Vorholt, Elizabeth Skovran, Jean-Charles Portais, Mary E. Lidstrom: Identification of a Fourth Formate Dehydrogenase in Methylobacterium extorquens AM1 and Confirmation of the Essential Role of Formate Oxidation in Methylotrophy. In: Journal of Bacteriology. Band 189, Nr. 24, 15. Dezember 2007, S. 9076–9081, doi:10.1128/JB.01229-07.
- William M. Reed, Patrick R. Dugan: Isolation and Characterization of the Facultative Methylotroph Mycobacterium ID-Y. In: Microbiology. 133. Jahrgang, Nr. 5, 1987, S. 1389–1395, doi:10.1099/00221287-133-5-1389, PMID 3655742 (englisch).
- Munusamy Madhaiyan, Selvaraj Poonguzhali, Soon-Wo Kwon, Tong-Min Sa: Methylophilus rhizosphaerae sp. nov., a restricted facultative methylotroph isolated from rice rhizosphere soil. In: International Journal of Systematic and Evolutionary Microbiology, Band 59, Nr. 11, 1. November 2009, S. 2904–2908; doi:10.1099/ijs.0.009811-0.
- NCBI Taxonomy Browser: Methylobrevis pamukkalensis Poroshina et al. 2015 (species).
- Maria N. Poroshina, Yuri A. Trotsenko, Nina V. Doronina: Methylobrevis pamukkalensis gen. nov., sp. nov., a halotolerant restricted facultative methylotroph isolated from saline water. In: International Journal of Systematic And Evolutionary Microbiology, Band 65, Nr. Pt_4, 1. April 2015; doi:10.1099/ijs.0.000105.
- NCBI Taxonomy Browser: Methylovorus, Details: Methylovorus Govorukhina and Trotsenko 1991 emend. Doronina et al. 2005 (species).
- Natalia I. Govorukhina, Yuri A. Trotsenko: Methylovorus, a New Genus of Restricted Facultatively Methylotrophic Bacteria Free. In: International Journal of Systematic And Evolutionary Microbiology, Band 41, Nr. 1, 1. Januar 1991; doi:10.1099/00207713-41-1-158.
- Ekaterina Ivanova, Nina Doronina, Yuri Trotsenko: Hansschlegelia plantiphila gen. nov. sp. nov., a new aerobic restricted facultative methylotrophic bacterium associated with plants. In: Systematic and Applied Microbiology, Band 30, Nr. 6, 10. September 2007, S. 444–452; doi:10.1016/j.syapm.2007.03.001.
- Nadezhda V. Agafonova, Elena N. Kaparullina, Denis S. Grouzdev and Nina V. Doronina: Hansschlegelia quercus sp. nov., a novel methylotrophic bacterium isolated from oak buds. In: International Journal of Systematic and Evolutionary Microbiology, Band 70, Nr. 8, 15. Juli 2020, S. 4646–4652; doi:10.1099/ijsem.0.004323.
- Stephen C. Taylor, Howard Dalton, Crawford S. Dow: Ribulose-1,5-bisphosphate Carboxylase/Oxygenase and Carbon Assimilation in Methylococcus capsulatus (Bath). In: Microbiology. 122. Jahrgang, Nr. 1, 1. Januar 1981, S. 89–94, doi:10.1099/00221287-122-1-89 (englisch).
- NCBI Taxonomy Browser: Ogataea polymorpha (Morais & M.H. Maia) Y. Yamada, K. Maeda & Mikata, 1994 (specie), basionym: Hansenula polymorpha Morais & M.H. Maia, 1959.
- Hiroya Yurimoto, Masahide Oku, Yasuyoshi Sakai: Yeast Methylotrophy: Metabolism, Gene Regulation and Peroxisome Homeostasis. In: International Journal of Microbiology. 2011-07-07. Jahrgang, 2011, ISSN 1687-918X, S. 101298, doi:10.1155/2011/101298, PMID 21754936, PMC 3132611 (freier Volltext) – (englisch).
- NCBI Taxonomy Browser: Saccharomycetales, Details: Saccharomycetales (order)
- EC 1.1.2.7 methanol dehydrogenase (cytochrome c), MDH (Hexulosephosphat-Isomerase). Auf: Expasy.
-
Vanessa Wegat, Jonathan T. Fabarius, Volker Sieber: Synthetic methylotrophic yeasts for the sustainable fuel and chemical production. In: BMC: Biotechnology for Biofuels and Bioproducts, Band 15, Nr. 113, 22. Oktober 2022; doi:10.1186/s13068-022-02210-1. Siehe insbes. auch Fig. 3: Metabolic access points of synthetic and native methylotrophic pathways into glycolytic yeast metabolism.
Anm. zu Fig. 1: Lt. NCBI-Taxonomie ist Hansenula polymorpha Basionym für die Hefe mit gültiger Bezeichnung Ogataea polymorpha. - Mykhailo Gonchar, Mykola Maidan, Yaroslav Korpan, Volodymyr Sibirny, Zbigniew Kotylak, Andrei Sibirny: Metabolically engineered methylotrophic yeast cells and enzymes as sensor biorecognition elements. In: FEMS Yeast Research. 2. Jahrgang, Nr. 3, 1. August 2002, ISSN 1567-1356, S. 307–314, doi:10.1016/s1567-1356(02)00124-1, PMID 12702280 (englisch).
- Ida J. van der Klei, Hiroya Yurimoto, Yasuyoshi Sakai, Marten Veenhuis: The significance of peroxisomes in methanol metabolism in methylotrophic yeast. In: Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763. Jahrgang, Nr. 12, Dezember 2006, S. 1453–1462, doi:10.1016/j.bbamcr.2006.07.016, PMID 17023065 (englisch). PDF.
- Christine A. Raines: The Calvin cycle revisited. In: Photosynthesis Research. 75. Jahrgang, Nr. 1, 1. Januar 2003, ISSN 0166-8595, S. 1–10, doi:10.1023/A:1022421515027, PMID 16245089 (englisch).
- Marie-Louise Champigny, Evelyne Bismuth: Role of Photosynthetic Electron Transfer in Light Activation of Calvin Cycle Enzymes. In: Physiologia Plantarum. 36. Jahrgang, Nr. 1, 1. Januar 1976, ISSN 1399-3054, S. 95–100, doi:10.1111/j.1399-3054.1976.tb05034.x (englisch).
- Stephen C. Taylor, Howard Dalton, Crawford S. Dow: Purification and initial characterisation of ribulose 1,5-bisphosphate carboxylase from Methylococcus capsulatus (Bath). In: FEMS Microbiology Letters. 8. Jahrgang, Nr. 3, 1. Juli 1980, S. 157–160, doi:10.1016/0378-1097(80)90021-x (englisch).
- NCBI Taxonomy Browser: Methylomonas methanica! Details: Methylomonas methanica (ex Söhngen 1906) Whittenbury and Krieg 1984 (species).
- J. R. Quayle: Microbial assimilation of C1 compounds. In: Biochemical Society Transactions. 8. Jahrgang, Nr. 1, 1. Februar 1980, ISSN 0300-5127, S. 1–10, doi:10.1042/bst0080001, PMID 6768606 (englisch).
- CAS 53010-97-2. D-arabino-3-Hexulose, 6-(dihydrogen phosphate). Auf: Chemical Abstracts Service.
- Arabino-3-hexulose-6-phosphate. Auf: Hairu (hairuchem.com).
-
Pathway: formaldehyde assimilation II (assimilatory RuMP Cycle). Auf: MetaCyc (biocyc.org/META)
- Main Compounds Only, Memento im Webarchiv (web.archive.org) vom 20. Mai 2021.
- Main compound structures
- Ribulosemonophosphat-Zyklus. Lexikon der Biologie. Auf: spektrum.de.
- EC 4.1.2.43 3-hexulose-6-phosphate synthase (Hexulosephosphat-Synthase, HPS). Auf: Expasy.
- L. V. Chistoserdova, M. E. Lidstrom: Genetics of the serine cycle in Methylobacterium extorquens AM1: identification, sequence, and mutation of three new genes involved in C1 assimilation, orf4, mtkA, and mtkB. In: Journal of Bacteriology. 176. Jahrgang, Nr. 23, 1. Dezember 1994, ISSN 0021-9193, S. 7398–7404, doi:10.1128/jb.176.23.7398-7404.1994, PMID 7961516, PMC 197134 (freier Volltext) – (englisch).
- Martin A. Gleeson, Peter E. Sudbery: The methylotrophic yeasts. In: Yeast. 4. Jahrgang, Nr. 1, 1. März 1988, ISSN 1097-0061, S. 1–15, doi:10.1002/yea.320040102 (englisch). SciSpace.
- CAS 60802-29-1. Pentulose, 5-phosphate. Auf: Chemical Abstracts Service.
- M. J. Waites, J. R. Quayle: The Interrelation between Transketolase and Dihydroxyacetone Synthase Activities in the Methylotrophic Yeast Candida boidinii. In: Microbiology. 124. Jahrgang, Nr. 2, 1. Juni 1981, S. 309–316, doi:10.1099/00221287-124-2-309, PMID 6276498 (englisch).
- Guillaume Borrel, Didier Jézéquel, Corinne Biderre-Petit, Nicole Morel-Desrosiers, Jean-Pierre Morel, Pierre Peyret, Gérard Fonty, Anne-Catherine Lehours: Production and consumption of methane in freshwater lake ecosystems. In: Research in Microbiology. Band 162, Nr. 9, November 2011, S. 832–847, doi:10.1016/j.resmic.2011.06.004.
- Julie Dinasquet, Marja Tiirola, Farooq Azam: Enrichment of Bacterioplankton Able to Utilize One-Carbon and Methylated Compounds in the Coastal Pacific Ocean. In: Frontiers in Marine Science. 5. Jahrgang, 6. September 2018, ISSN 2296-7745, S. 307, doi:10.3389/fmars.2018.00307 (englisch).
- Josh D. Neufeld, Rich Boden, Hélène Moussard, Hendrik Schäfer, J. Colin Murrell: Substrate-Specific Clades of Active Marine Methylotrophs Associated with a Phytoplankton Bloom in a Temperate Coastal Environment. In: Applied and Environmental Microbiology. 74. Jahrgang, Nr. 23, 1. Dezember 2008, S. 7321–7328, doi:10.1128/AEM.01266-08, PMID 18849453, PMC 2592898 (freier Volltext), bibcode:2008ApEnM..74.7321N (englisch).
- Daphne Faria, LokaBharathi Adikesavan Ponnapakkam: Marine and estuarine methylotrophs: their abundance, activity and identity. In: Current Science. 90. Jahrgang, Nr. 7, April 2006, ISSN 0011-3891, S. 984–989, JSTOR:24091957 (englisch). ResearchGate.
- M. Yang, R. Beale, P. Liss, M. Johnson, B. Blomquist, P. Nightingale: Air–sea fluxes of oxygenated volatile organic compounds across the Atlantic Ocean. In: Atmospheric Chemistry and Physics. 14. Jahrgang, Nr. 14, 24. Juli 2014, ISSN 1680-7316, S. 7499–7517, doi:10.5194/acp-14-7499-2014, bibcode:2014ACP....14.7499Y (englisch, copernicus.org).
- Rachael Beale, Peter S. Liss, Joanna L. Dixon, Philip D. Nightingale: Quantification of oxygenated volatile organic compounds in seawater by membrane inlet-proton transfer reaction/mass spectrometry. In: Analytica Chimica Acta. 706. Jahrgang, Nr. 1, 7. November 2011, ISSN 0003-2670, S. 128–134, doi:10.1016/j.aca.2011.08.023, PMID 21995919 (englisch).
- Timothy E. Mattes, Brook L. Nunn, Katharine T. Marshall, Giora Proskurowski, Deborah S. Kelley, Orest E. Kawka, David R. Goodlett, Dennis A. Hansell, Robert M. Morris: Sulfur oxidizers dominate carbon fixation at a biogeochemical hot spot in the dark ocean. In: The ISME Journal. 7. Jahrgang, Nr. 12, Dezember 2013, ISSN 1751-7370, S. 2349–2360, doi:10.1038/ismej.2013.113, PMID 23842654, PMC 3834846 (freier Volltext) – (englisch).
- Ludmila Chistoserdova: Application of Omics Approaches to Studying Methylotrophs and Methylotroph Communities. In: Current Issues in Molecular Biology. 24. Jahrgang, 6. Juli 2017, ISSN 1467-3037, S. 119–142, doi:10.21775/cimb.024.119, PMID 28686571 (englisch).
- Manish Kumar, Rajesh Singh Tomar, Harshad Lade, Diby Paul: Methylotrophic bacteria in sustainable agriculture. In: World Journal of Microbiology and Biotechnology. 32. Jahrgang, Nr. 7, 2016, S. 120, doi:10.1007/s11274-016-2074-8, PMID 27263015 (englisch).
- Hiroyuki Iguchi, Hiroya Yurimoto, Yasuyoshi Sakai: Interactions of methylotrophs with plants and other heterotrophic bacteria. In: MDPI Microorganisms. 3. Jahrgang, Nr. 2, 2. April 2015, S. 137–151, doi:10.3390/microorganisms3020137, PMID 27682083, PMC 5023238 (freier Volltext) – (englisch).