N,N′-Methylenbisacrylamid
N,N′-Methylenbisacrylamid (MBA) ist ein symmetrisches, nicht-konjugiertes bifunktionelles Vinyl-Monomer, das als Vernetzer, insbesondere für Polyacrylamid-Gele Verwendung findet.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
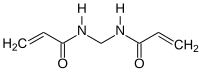 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N,N′-Methylenbisacrylamid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H10N2O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 154,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,235 g·cm−3 (30 °C)[4] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Acrylamid reagiert in wässriger Lösung mit Formaldehyd-Lösung in Gegenwart von Kupfer(I)-chlorid als Polymerisationsinhibitor und verdünnter Schwefelsäure als Katalysator in Ausbeuten von 60 bis 80 % zu N,N′-Methylenbisacrylamid.[8][9]
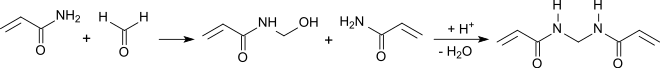
Die Reaktion verläuft über das in alkalischem Medium fassbare N-Hydroxymethylacrylamid durch Wasserabspaltung im Sauren zu N,N′-Methylenbisacrylamid[10] und liefert bei Einsatz von Acrylamid und Paraformaldehyd in 1,2-Dichlorethan beim Erhitzen in Gegenwart von konzentrierter Salzsäure eine klare Lösung, aus der MBA dann auskristallisiert.
In wässrig-saurem Medium reagiert auch Acrylnitril mit Formaldehyd-Lösung zu rohem N,N′-Methylenbisacrylamid aus dem durch Umkristallisieren aus Aceton/Wasser die Reinsubstanz erhalten werden kann.[11]

Eigenschaften
N,N′-Methylenbisacrylamid ist ein weißer und geruchloser kristalliner Feststoff, der sich wenig in kaltem Wasser löst.
| Löslichkeiten in Wasser[6] | ||||||||||||
| Temperatur | in °C | 10 | 25 | 50 | 90 | |||||||
| Löslichkeit | in g/100 ml | 2,0 | 3,0 | 6,5 | 42,0 | |||||||
Bei Zugabe geringer Mengen Natronlauge löst sich die Substanz hingegen bei Raumtemperatur sehr gut in aprotisch dipolaren Lösungsmitteln, wie Dimethylformamid und N-Methylpyrrolidon.[7]
| Löslichkeiten in organischen Lösungsmitteln[6] | ||||||||||||
| Lösungsmittel | bei 30 °C | Aceton | Benzol | Chloroform | Dioxan | Ethanol | Ethylacetat | Methanol | n-Heptan | |||
| Löslichkeit | in g/100 ml | 1,0 | < 1,0 | 0,3 | 1,1 | 5,4 | 0,4 | 8,2 | < 0,02 | |||
Die Zersetzung von MBA bei hohen Temperaturen erzeugt Wasser, Kohlendioxid und Stickstoff, aber kein Acrylamid.[6]
Anwendungen
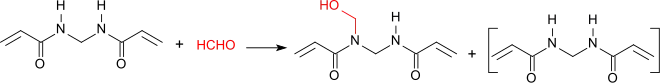
Unter basischen Bedingungen reagiert MBA mit Formaldehyd am Amid-Stickstoff unter Bildung eines Gemisches von MBA und der N-Methylolverbindung N-Hydroxymethyl,N,N′-Methylenbisacrylamid.
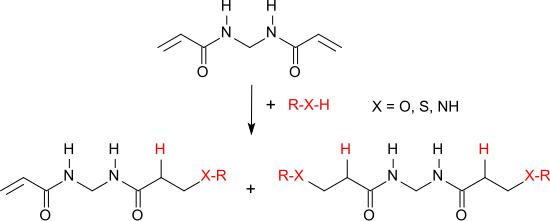
Nukleophile, wie z. B. Alkohole, Amine oder Thiole werden an die aktivierten Vinylgruppen von N,N′-Methylenbisacrylamid addiert, wobei Mischungen aus Mono- und Disubstitutionsprodukten entstehen.
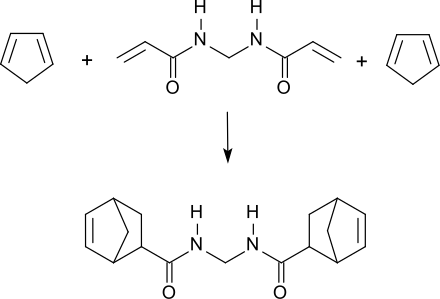
Als elektronenarmes Dienophil bildet das bifunktionelle MBA mit elektronenreichen Dienen, wie z. B. Cyclopentadien, in einer Diels-Alder-Reaktion das entsprechende Bis-Norbornen-Addukt.[6]
Das symmetrische nicht-konjugierte Divinyl-Monomer N,N′-Methylenbisacrylamid kann mit geeigneten Initiatoren in einer Cyclopolymerisation zu linearen, löslichen Polymeren umgesetzt werden, deren Rückgrat aus fünf- und siebengliedrigen Ringen aufgebaut sein soll.[12][13][14]
Mit Acryl- und Vinyl-Monomeren wie Acrylnitril, Acrylamid, substituierten Acrylamiden, wie z. B. N-Isopropylacrylamid, Acrylsäure und Acrylate, sowie Derivaten dieser Verbindungen (z. B. Methacrylate) kann N,N′-Methylenbisacrylamid in Lösung, in Emulsion oder in Suspension radikalisch mit Peroxiden, wie z. B. Benzoylperoxid[15] Azoverbindungen z. B. AIBN[16] oder UV-Licht[17] oder auch durch Redoxinitiation, z. B. mit Ammoniumperoxodisulfat (APS)/Tetramethylethylendiamin (TMEDA)[18] unter Bildung hochvernetzter Gele copolymerisiert werden.
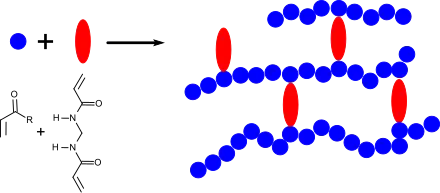
Die Eigenschaften des mit MBA vernetzten Gels werden von der molaren Masse des zugrunde liegenden Polymers, der Polymerkonzentration und der MBA-Konzentration, d. h. von der Vernetzungsdichte bestimmt. Die gezielte Gelbildung durch Vernetzung mit N,N′-Methylenbisacrylamid verleiht (wasser)löslichen Polymeren äußerst nützliche technische Eigenschaften, die sich in einer Vielzahl von Anwendungen manifestieren, wie z. B. in Klebstoffen, Verdickern, Lacken und Beschichtungen und Superabsorbern.
Da Methylenbisacrylamid zwei Doppelbindungen zwischen Kohlenstoffatomen enthält, wird es als Quervernetzer bei der radikalischen Polymerisation von wässrigen Acrylamidlösungen eingesetzt. In der Biochemie wird es für Chromatographiegele und Polyacrylamid-Gelelektrophoresen verwendet, z. B. bei der SDS-PAGE, bei der BAC-PAGE, bei der CTAB-PAGE und in DNA-Sequenziergelen.
Einzelnachweise
- Eintrag zu N,N'-METHYLENEBISACRYLAMIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- Datenblatt N,N′-Methylen-bis-acrylamid bei Sigma-Aldrich, abgerufen am 30. November 2015 (PDF).
- Eintrag zu N,N′-Methylenebisacrylamide (for Electrophoresis) bei TCI Europe, abgerufen am 30. November 2015.
- Eintrag zu N,N'-Methylenbis(acrylamid) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- Datenblatt N,N′-Methylenbisacrylamid für die Electrophorese bei Merck, abgerufen am 30. November 2015.
- SNF Floerger: Produktbroschüre Flocryl® MBA, abgerufen am 1. Mai 2018.
- Patent US5354903: Polymers prepared from concentrated solutions of N,N′-methylenebisacrylamide. Angemeldet am 24. Dezember 1992, veröffentlicht am 11. Oktober 1994, Anmelder: Ionics, Inc., Erfinder: R.J. MacDonald.
- Patent US2475846: Alkylidene-bis-acrylamides. Angemeldet am 31. Oktober 1946, veröffentlicht am 12. Juli 1949, Anmelder: American Cyanamid, Co., Erfinder: L.A. Lundberg.
- H. Petersen, Amino-Harze in Houben-Weyl Methods of Organic Chemistry, Vol. E20, Thieme Stuttgart New York 1987, ISBN 978-3-13-219004-7, S. 1855.
- H. Feuer, U.E. Lynch: The synthesis and reactions of unsaturated N-methylolamides. In: J. Am. Chem. Soc. Band 75, Nr. 20, 1953, S. 5027–5029, doi:10.1021/ja01116a041.
- E.E. Magat, B.F. Faris, J.E. Reith, L.F. Salisbury: Acid-catalyzed reactions of nitriles. I. The reaction of nitriles with formaldehyde. In: J. Am. Chem. Soc. Band 73, Nr. 3, 1951, S. 1028–1031, doi:10.1021/ja01147a042.
- A. Gopalan, S. Paulrajan, N.R. Subbaratnam, K. Venkata Rao: Cyclopolymerization of N,N′-methylene bisacrylamide initiated by S2O82−–Fe2+ redox system. In: J. Polym. Chem. Band 38, Nr. 10, 2005, S. 4465–4471, doi:10.1021/ma0502497.
- K. Behari, U. Agrawal, R. Das: Gel free polymerization of N,N′-methylenebisacrylamide initiated by a peroxodiphosphate-thioacetamide redox system. A kinetic study. In: Polym. J. Band 25, Nr. 10, 1993, S. 1007–1013, doi:10.1295/polymj.25.1007.
- N. Krishnaveni, M. Umayavalli: Cyclopolymerization of N,N′-methylenebisacrylamide with N,N-dimethylaniline-trichloroacetic acid and N,N-dimethylaniline-benzoyl chloride systems in aqueous medium. In: J. Chem. Pharm. Res. Band 6, Nr. 9, 2014, S. 349–359 (jocpr.com [PDF]).
- H.H. Prasad, A. Senger, K. Chauhan, K.M. Popat, P.S. Anand: Synthesis of crosslinked methacrylic acid-co-N,N'-methylene bis acrylamide sorbents for recovery of heavy metal ions from dilute solutions. In: Indian J. Chem. Technol. Band 8, 2001, S. 371–377 (14.139.47.15 [PDF]).
- A. Ekenseair, K.W.M. Boere, S.N. Tzouanas, T.N. Vo, F.K. Kasper, A.G. Mikos: Synthesis and Characterization of Thermally and Chemically Gelling Injectable Hydrogels for Tissue Engineering. In: Biomolecules. Band 13, Nr. 6, 2012, S. 1908–1915, doi:10.1021/bm300429e.
- N. F. Ayub, S. Hashim, J. Jamaluddin, R. Rasit Ali, N. Adrus: UV LED Curing Formulation for Polyacrylamide Hydrogels. In: Adv. Mater. Res. Band 1125, 2015, S. 84–88, doi:10.4028/www.scientific.net/AMR.1125.84.
- A. Chetty, J. Kovács, Zs. Sulyok, Á. Mészáros, J. Fekete, A. Domján, A. Szilágyi, V. Vargha: A versatile characterization of poly(N-isopropylacrylamideco-N,N′-methylene-bis-acrylamide) hydrogels for composition, mechanical strength, and rheology. In: eXPRESS Polym. Lett. Band 7, Nr. 1, 2013, S. 95–105, doi:10.3144/expresspolymlett.2013.9.

