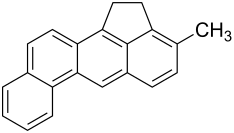
3-Methylcholanthren
3-Methylcholanthren oft mit 3-MC abgekürzt, nach der Steroid-Nomenklatur auch als 20-Methylcholanthren bezeichnet, ist ein polycyclischer aromatischer Kohlenwasserstoff. Der Grundkörper der Verbindung ist Cholanthren. 3-Methylcholanthren ist stark krebserregend. Es wird in der Onkologie als Karzinogen zum Auslösen von Tumoren in Modellorganismen verwendet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Methylcholanthren | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C21H16 | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 268,35 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,28 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
nicht eingestuft, da Verdacht auf krebserzeugende Wirkung[1] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Es wurde 1934 von James Wilfred Cook synthetisiert und als stark karzinogen erkannt.
Verwendung und Eigenschaften
Aufgrund seiner starken krebserzeugenden Wirkung gibt es keine technische Anwendung für 3-Methylcholanthren. In der Onkologie ist es ein häufig verwendetes Standard-Karzinogen, um bei Modellorganismen maligne Tumoren zu erzeugen.[2][3] 3-Methylcholanthren ist dabei ein potenteres Karzinogen als Benzo[a]pyren.[4] 3-Methylcholanthren ist in Bakterien mutagen und führt im Knochenmark zu Chromosomenbruch (klastogener Effekt). Im Tierversuch induziert es die Bildung von DNA-Addukten.[5]
Um Tumoren zu erzeugen bekommen die Versuchstiere 3-Methylcholanthren entweder auf die Haut gepinselt (transdermal) oder unter die Haut gespritzt (subkutan) oder über die Nahrung verabreicht (peroral) oder in die Bauchhöhle injiziert (intraperitoneal). Die so behandelten Tiere entwickeln in der Regel, abhängig vom Ort der Applizierung, verschiedene Arten von Krebs.[6]
Bei der Applizierung auf die Haut entwickeln sich bei Mäusen schnell Karzinome. Die subkutane Injektion führt bei Mäusen und Ratten zu Sarkomen. Die orale Gabe in einer Sesamölverdünnung induziert bei weiblichen Ratten Brustkrebs.[7] Werden zuvor die Eierstöcke entnommen, sinkt das Brustkrebsrisiko deutlich.[8]
Daneben beeinflusst 3-Methylcholanthren die Follikulogenese, den Estrogen-Haushalt, den Sexualzyklus[9] und die Morphologie der Spermien[10] der Versuchstiere.[11][12]
3-Methylcholanthren aktiviert den Aryl-Hydrocarbon-Rezeptor. Die Aktivierung des Ah-Rezeptors bewirkt wiederum eine Unterbrechung des Estradiol-Signalweges. In einigen Zellen wirkt 3-MC als Aktivator der Estrogen-Rezeptoren ER-α und ER-β, während es in anderen Zellen als Suppressor agiert. Die Wirkungsweise ist davon abhängig, ob die jeweilige Zelle in der Lage ist 3-MC zu metabolisieren.[13][14][15]
Je nach Organ und dort vorhandenen Enzymen wird 3-MC unterschiedlich metabolisiert. Als Metaboliten finden sich in der Leber unter anderem 1- oder 2-Hydroxy-, cis- und trans-1,2-Dihydroxy-, 11,12-Dihydroxy-11,12-dihydo- sowie 1- und 2-Keto-3-methylcholanthren.[16]
3-Methylcholanthren ist stark hydrophob. Der Oktanol-Wasser-Verteilungskoeffizient (log K) beträgt 6,42.[17] Das Absorptionsmaximum liegt in Ethanol bei 359 nm.[18]
Entdeckung und Synthese
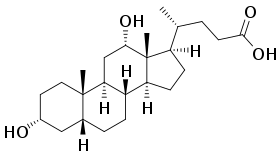
3-Methylcholanthren wurde erstmals von den beiden deutschen Chemikern Heinrich Otto Wieland und Elisabeth Dane 1933 entdeckt. Die beiden erhielten die Verbindung als Zersetzungsprodukt von Desoxycholsäure, einem Sterin aus der Familie der Steroide.[19] Die Rückführung der Desoxycholsäure auf das Grundgerüst eines reinen Kohlenwasserstoffs brachte den Strukturbeweis für die Desoxycholsäure.
Die erste Synthese von 3-Methylcholanthren erfolgte 1935 durch die beiden US-Amerikaner Louis Frederick Fieser und Arnold M. Seligman. Sie nutzten dabei die Elbs-Reaktion.[20][21][22][23]
J. W. Cook und G. A. D. Haslewood erkannten das kanzerogene Potenzial von 3-Methylcholanthren kurz nach der Entdeckung durch Wieland und Dane.[24][25][26]
Fieser postulierte 1936 in seinem Buch Chemistry of Natural Products Related to Phenanthrene, dass viele Krebserkrankungen ihren Ursprung in 3-MC und verwandten Verbindungen hätten, die als Stoffwechselprodukt – beispielsweise von Sexualhormonen oder Cholesterin – im Körpers anfallen. Diese These ist in dieser Form heute nicht mehr haltbar.[4]
In der Literatur sind mehrere elegantere Synthesewege zur Herstellung von 3-Methylcholantren beschrieben. So lässt sich beispielsweise aus 4-Methylindanon und N,N-Diethyl-1-naphthamid ein Lacton erhalten, das nach insgesamt vier Stufen zu 3-MC führt. Die Gesamtausbeute liegt bei etwa 20 %.[27]
Eine alternative Synthese geht über 5-Methylhomophthalsäureanhydrid, das mit in 2-Position lithiiertem 1-Naphthamid umgesetzt wird. Dieser Weg geht über fünf Stufen und hat eine Ausbeute von ungefähr 55 %.[28]
3-Methylcholanthren kann sich auch bei der Pyrolyse von Cholesterol-Derivaten bilden.[29]
Literatur
- P. Sims und P. L. Grover: Polycyclic Hydrocarbons and Cancer. H. V. Gelboin u. a. (Editoren), Academic Press, 1981.
- E. T. Bloom: Quantitative detection of cytetexic antibodies against tumorspecific antigens of murine sarcomas induced by 3-methylcholanthrene. In: J Natl Cancer Inst 44, 1970, S. 443, PMID 5523193.
- J. D. Kamp und H. G. Neumann: Absorption of carcinogens into the thoracic duct lymph of the rat: aminostilbene derivatives and 3-methylcholanthrene. In: Xenobiotica 5, 1975, S. 717–727.
- E. Bergmann und O. Blum-Bergmann: Synthesis of Methylcholanthrene. In: JACS 59, 1937, S. 1573–1575. doi:10.1021/ja01287a502
- L. W. Law und M. Lewisohn: Comparative Carcinogenicity of Some Cholanthrene Derivatives. (PDF; 358 kB) In: Cancer Research 1941, S. 695–698.
- M. J. Shear: Studies in Carcinogenesis. III. Isomers of Cholanthrene and Methylcholanthrene. In: Am J Cancer 28, 1936, S. 334–344.
Einzelnachweise
- Eintrag zu 3-Methylcholanthren in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2017. (JavaScript erforderlich)
- R. T. O. Turner u. a.: The role of complement in 3-methylcholanthrene-induced tumour formation. In: Molecular Immunology 44, 2007, S. 3950–3951. doi:10.1016/j.molimm.2007.06.099.
- D. L. Anger u. a.: Spontaneous appearance of uterine tumors in vehicle and 3-methylcholanthrene-treated Wistar rats. In: Reprod Toxicol 22, 2006, S. 760–764. PMID 16945501.
- M. M. Coombs und T. S. Bhatt: Cyclopenta(a)phenanthrenes. CUP Archive, 1987, S. 6. ISBN 0-521-30123-8.
- B. H. Rihn u. a.: Genotoxicity of 3-methylcholanthrene in liver of transgenic big Blue mice. In: Environ Mol Mutagen 36, 2000, S. 266–273.
- P. Bofetta u. a.: Cancer risk from occupational and environmental exposure to polycyclic aromatic hydrocarbons. In: Cancer Causes & Control 8, 1997, S. 444–472, PMID 9498904 (Übersichtsartikel).
- J. Doull u. a. (Editoren): Casarett and Doull's Toxicology. 3. Auflage, New York, Macmillan Co., Inc., 1986, S. 107.
- C. E. Searle (Editor): Chemical Carcinogens. ACS Monographie 173, Washington, American Chemical Society, 1976, S. 73.
- M. Konstandi u. a.: Modification of reproductive function in the rat by 3-methylcholanthrene. In: Pharmacol Res 35, 1997, S. 107–111, PMID 9175578.
- A. J. Wyrobek und W. R. Bruce: Chemical induction of sperm abnormalities in mice. In: PNAS 72, 1975, S. 4425–4429, PMID 1060122.
- S. M. Borman u. a.: Ovotoxicity in female Fischer rats and B6 mice induced by low-dose exposure to three polycylic aromatic hydrocarbons: comparison through calculation of an ovotoxic index. In: Toxicol Appl Pharmacol 167, 2000, S. 248–254, PMID 10986010.
- D. L. Anger u. a.: Spontaneous appearance of uterine tumors in vehicle and 3-methylcholanthrene-treated Wistar rats. In: Reproductive Toxicology 22, 2006, S. 760–764, PMID 16945501.
- E. Swedenborg: 3-Methylcholanthrene displays dual effects on estrogen receptor (ER) alpha and ER beta signaling in a cell-type specific fashion. In: Mol Pharmacol 73, 2008, S. 575–586, PMID 18003862.
- S. R. Myers und J. W. Flesher: Metabolism of the carcinogen 3-methylcholanthrene in human bone marrow preparations. In: Drug Metab Dispos 18, 1990, S. 664–669, PMID 1981717.
- M. G. Shou und S. K. Yang: Metabolism of 2S-hydroxy-3-methylcholanthrene by rat liver microsomes. In: Carcinogenesis 11, 1990, S. 2037–2045, PMID 2225338.
- G. D. Clayton und F. E. Clayton (Editoren): Patty's Industrial Hygiene and Toxicology: Volume 2A, 2B, 2C: Toxicology. dritte Auflage, John Wiley Sons, 1981–1982. S. 3367.
- C. Hansch und A. Leo: Substituent Constants for Correlation Analysis in Chemistry and Biology. New York, John Wiley and Sons, 1979.
- R. C. Weast (Editor): Handbook of Chemistry and Physics. 60. Auflage, CRC Press Inc., 1979, S. C–245.
- H. Wieland und E. Dane: In: Z physiol Chem 219, 1933, S. 240.
- L. F. Fieser und A. M. Seligman: The Synthesis of Methylcholanthrene. In: JACS 57, 1935, S. 228–229, doi:10.1021/ja01304a508
- L. F. Fieser und A. M. Seligman: The Synthesis of Methylcholanthrene. In: JACS 57, 1935, S. 942–946, doi:10.1021/ja01308a050.
- L. F. Fieser und A. M. Seligman: An Improved Method for the Synthetic Preparation of Methylcholanthrene. In: JACS 58, 1936, S. 2482–2487, doi:10.1021/ja01303a037.
- L. F. Fieser und E. B. Hershberg: Reduction and Hydrogenation of Methylcholanthrene. In: JACS 60, 1938, S. 940–946, doi:10.1021/ja01271a054.
- J. W. Cook und G. A. D. Haslewood: The conversion of a bile acid into a hydrocarbon derived from 1:2-benzanthracene. In: J Chem Soc 428, 1933, S. 758–759.
- J. W. Cook und G. A. D. Haslewood: The Synthesis of 5:6-Dimethyl-1:2-benzanthraquinone, a Degradation Product of Deoxycholic Acid. In: J Chem Soc 1934, S. 428–433.
- J. W. Cook u. a.: Chemical Compounds as Carcinogenic Agents. In: Am J Cancer 29, 1937, S. 219–259.
- S. A. Jacobs und R. G. Harvey: Synthesis of 3-methylcholanthrene. In: Tetrahedron letters 22, 1981, S. 1093–1096.
- T. Gimisis und M. Koreeda: A highly efficient synthesis of 3-methylcholanthrene. In: J Org Chem 58, 1993, S. 7158–7161, doi:10.1021/jo00077a045.
- Merck-Index, 10. Edition, 1983, S. 867.
