Methoxetamin
Methoxetamin (MXE) oder 3-MeO-2’-Oxo-PCE gehört strukturell zur Gruppe der Arylcyclohexylamine und ist damit ein Derivat des Ketamins, das auch strukturelle Eigenschaften mit Eticyclidin und 3-MeO-PCP gemein hat. Es wird vermutet, dass Methoxetamin als NMDA-Rezeptorantagonist und Dopamin-Wiederaufnahmehemmer wirkt, dies wurde allerdings nur für die NMDA-Rezeptorwirkung formal nachgewiesen.[4] Methoxetamin unterscheidet sich von vielen anderen dissoziativen Anästhetika dadurch, dass es speziell für die Distribution auf halblegalen Märkten entwickelt wurde.[5]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
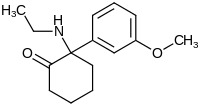 | |||||||||||||
| Struktur ohne Stereochemie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Methoxetamin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C15H21NO2 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff (Hydrochlorid)[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 247,33 g·mol−1 (Base) | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Stereochemie
Methoxetamin ist eine chirale Verbindung, die ein asymmetrisch substituiertes Kohlenstoffatom enthält. Die Verbindung liegt daher in der Regel als 1:1-Gemisch (Racemat) von zwei spiegelbildlichen Molekülen (Enantiomeren) vor, die sich in bestimmten physikalischen Eigenschaften und physiologischen Wirkungen unterscheiden können. Durch geeignete Synthesestrategien (siehe auch: enantiomerenreine Arzneistoffsynthese) oder Trennverfahren (Racematspaltung) lassen sich gezielt die einzelnen Stereoisomere isolieren. Nach der folgenden Synthese fällt Methoxetamin als Racemat an.[6]
Synthese

Durch Umsetzung von 3-Methoxybenzonitril mit Cyclopentylmagnesiumbromid wird das entsprechende Keton erhalten. Mit elementarem Brom entsteht ein tertiäres Bromid. Dies hydrolysiert in Gegenwart von Ethylamin und erhält dabei sowohl eine Hydroxygruppe und die Imin-Funktion. Durch Erhitzen lagert diese Verbindung zum Methoxetamin um.[6]
Wirkung
Bisher wurde durch die ähnliche Bindungsweise am NMDA-Glutamat-Rezeptor eine ähnliche Wirkung wie die des Ketamins beschrieben, wie z. B. dissoziatives Erleben, erhöhter Puls (Tachykardie) und erhöhter Blutdruck (arterielle Hypertonie).[7] Allerdings ist durch die 3-Methoxy-Substituierung die schmerzlindernde Wirkung des MXE durch die Bindung am µ1-Opioid-Rezeptor stärker ausgeprägt als bei Ketamin; im Gegensatz zur dissoziativen Wirkung, die schwächer ausgeprägt ist.[5][8] Weiterhin sind Euphorie, Empathie, Halluzinationen, Schwindel, Verwirrtheitszustände, motorische Störungen und kurzfristiger Gedächtnisverlust als Wirkungen beschrieben. Mangels Langzeitstudien ist nichts über die Toxizität von MXE bekannt, daher kann es bei Missbrauch zu gesundheitlichen Problemen kommen.[7]
Rechtslage

- Deutschland
- In Deutschland ist Methoxetamin seit 17. Juli 2013 mit der 27. Betäubungsmittel-Änderungsverordnung in der Anlage I des Betäubungsmittelgesetz aufgeführt und damit als nicht verkehrsfähiger Stoff klassifiziert.[9][10]
- Europäische Union
Weblinks
- MXE. In: Erowid. (englisch)
- Hamilton Morris: Interview mit einem Ketamin-Chemiker. Vice Magazine.
- Patrick A. Hays, John F. Casale, Arthur L. Berrier U.S. Department of Justice Drug Enforcement Administration: The Characterization of 2-(3-Methoxyphenyl)-2-(ethylamino)cyclohexanone (Methoxetamine). (PDF; 1,9 MB) In: Microgram Journal. Volume 9, Number 1, 2012, S. 3–17.
Literatur
- M. T. Zanda, P. Fadda, C. Chiamulera, W. Fratta, L. Fattore: Methoxetamine, a novel psychoactive substance with serious adverse pharmacological effects: a review of case reports and preclinical findings. In: Behavioural pharmacology. Band 27, Nummer 6, September 2016, S. 489–496, doi:10.1097/FBP.0000000000000241, PMID 27128862.
- J. B. Zawilska: Methoxetamine – a novel recreational drug with potent hallucinogenic properties. In: Toxicology letters. Band 230, Nummer 3, November 2014, S. 402–407, doi:10.1016/j.toxlet.2014.08.011, PMID 25128700 (Review).
- A. Kjellgren, K. Jonsson: Methoxetamine (MXE) – a phenomenological study of experiences induced by a "legal high" from the internet. In: Journal of psychoactive drugs. Band 45, Nummer 3, 2013 Jul–Aug, S. 276–286, doi:10.1080/02791072.2013.803647, PMID 24175493, PMC 3756617 (freier Volltext).
- Jennifer E. Shields, Paul I. Dargan, David M. Wood, Malgorzata Puchnarewicz, Susannah Davies, W. Stephen Waring: Methoxetamine associated reversible cerebellar toxicity: Three cases with analytical confirmation. In: Clinical Toxicology. June 2012, Vol. 50, No. 5, 438–440, PMID 22578175. doi:10.3109/15563650.2012.683437
- O. Corazza, F. Schifano, P. Simonato, S. Fergus, S. Assi u. a.: Phenomenon of new drugs on the Internet: the case of ketamine derivative methoxetamine. In: Hum Psychopharmacol. 27(2), 2012 Mar, S. 145–149. PMID 22389078. doi:10.1002/hup.1242
- J. Ward, S. Rhyee, J. Plansky, E. Boyer: Methoxetamine: a novel ketamine analog and growing health-care concern. In: Clin Toxicol (Phila). 49(9), 2011 Nov, S. 874–875. Epub 2011 Oct 7. PMID 21981756.
Einzelnachweise
- SWGDRUG Monographs: Methoxetamine Monograph (PDF; 511 kB), abgerufen am 20. Mai 2013.
- Cayman Chemical Company: Methoxetamine (hydrochloride) SAFETY DATA SHEET (PDF; 23 kB), abgerufen am 19. Mai 2013.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Bryan L. Roth, Simon Gibbons, Warunya Arunotayanun, Xi-Ping Huang, Vincent Setola, Ric Treble, Les Iversen, Kenji Hashimoto: The Ketamine Analogue Methoxetamine and 3- and 4-Methoxy Analogues of Phencyclidine Are High Affinity and Selective Ligands for the Glutamate NMDA Receptor. In: PLoS ONE. 8, 2013, S. e59334, doi:10.1371/journal.pone.0059334.
- Hamilton Morris: Interview mit einem Ketamin-Chemiker. In: Vice Magazine. Abgerufen am 3. Februar 2012.
- Patrick A. Hays, John F. Casale, Arthur L. Berrier (U.S. Department of Justice Drug Enforcement Administration): The Characterization of 2-(3-Methoxyphenyl)-2-(ethylamino)cyclohexanone (Methoxetamine). (PDF; 1,9 MB) In: Microgram Journal. Volume 9, Number 1, 2012, S. 3–17.
- D. M. Wood, S. Davies, M. Puchnarewicz, A. Johnston, P. I. Dargan: Acute toxicity associated with the recreational use of the ketamine derivative methoxetamine. In: European Journal of Clinical Pharmacology. 2011, PMID 22205276.
- D. M. Wood, S. Davies, A. Calapis, J. Ramsey, P. I. Dargan: Novel drugs -novel branding. In: QJM. 2011 Oct 13. PMID 21997441. doi:10.1093/qjmed/hcr191
- Bundesministerium für Gesundheit: Kabinett beschließt 27. Betäubungsmittel-Änderungsverordnung. Pressemitteilung vom 22. Mai 2013, abgerufen am 26. Mai 2013.
- Bundesministerium für Gesundheit: Verordnungsentwurf der Bundesregierung: Siebenundzwanzigste Verordnung zur Änderung betäubungsmittelrechtlicher Vorschriften (PDF; 73kb). (Memento vom 21. Februar 2014 im Internet Archive) Abgerufen am 17. Juli 2013.
- Durchführungsbeschluss des Rates vom 25. September 2014 (2014/688/EU) (PDF) abgerufen am 17. Oktober 2014.
- EU verbietet vier gefährliche Designer-Drogen. auf: aerzteblatt.de, 26. September 2014, abgerufen am 17. Oktober 2014.
- MDPV, 25I-NBOMe, AH-7921 und Methoxetamin : EU verbietet vier neuartige Drogen. auf: rp-online.de, 25. September 2014, abgerufen am 17. Oktober 2014.