Mesoionische Verbindungen
Mesoionische Verbindungen sind chemische Verbindungen aus der Stoffklasse der konjugierten heterocyclischen Betaine. Es handelt sich um dipolare 5-Ring-Heterocyclen mit einem π-Elektronensextett, die nach außen hin ungeladen sind. Für diese Verbindungen lässt sich jedoch keine mesomere Grenzstruktur ohne positive und negative Ladungen formulieren und man kann sie nur durch mehrere mesomere Grenzstrukturen hinreichend beschreiben.[1] Die Bezeichnung mesoionisch wurde 1949 durch Wilson Baker und William David Ollis aus den Begriffen mesomer und ionisch geprägt.[2]
Geschichte
Das erste Beispiel einer mesoionischen Verbindung wurde 1882 unwissentlich von Emil Fischer und Emil Besthorn beschrieben.[3] Durch Oxidation von Dithizon (1) erhält man eine Verbindung, für die Fischer die 1,5-Diphenylthiocarbodiazon-Struktur (2) formulierte. Von Eugen Bamberger und Mitarbeitern wurde später stattdessen die Betain-Struktur (3) vorgeschlagen.[4] Bis in die 60er Jahre war der Strukturvorschlag nach Fischer allgemein akzeptiert. UV-spektroskopische Untersuchungen, sowie Untersuchungen zu den chemische Eigenschaften der Verbindung deuteten jedoch darauf hin, dass die Struktur nach Bamberger korrekt ist.[5] Die mesoionische Struktur für das Dehydrodithiazon – 2,3-Diphenyltetrazolium-5-thiolat – konnte 1969 bestätigt werden.[6][7]

Von 1895 bis 1905 wurden etliche mesoionische Heterocyclen von Max Busch hergestellt und untersucht. Er formulierte für die Verbindungen bicyclische Strukturen; erst etwa 30 Jahre später wurde die mesoionische Struktur erkannt. 1935 gelang John Campbell Earl und Alan W. Mackney die Herstellung von N-Phenylsydnon.[8] Baker und Ollis konnten zeigen, dass die Sydnone zu der großen Familie von Heterocyclen gehören, für die sie die Bezeichnung mesoionische Verbindungen prägten. In der Folgezeit wurden weitere nesoionische Systeme synthetisiert, wie beispielsweise 1964 die Münchnone durch Rolf Huisgen.[9]
Strukturelle Einteilung
Zu einem konjugierten 5-Ring-Heterocyclus mit einem exocyclischen Substituenten gehören insgesamt acht π-Elektronen. Abhängig von der Herkunft der π-Elektronen kann man diese Verbindungen in 6 verschiedene Typen einteilen:

a–f: substituiertes Kohlenstoff- oder Heteroatom. rot: 2 π-Elektronen, blau: 1 π-Elektron
Die rot markierten Atome steuern zwei π-Elektronen und die blau markierten Atome ein π-Elektron zu dem konjugierten System bei. Die Heterocyclen des Typs 1 und 2 können durch eine kovalente Struktur ohne Ladungen dargestellt werden. Die Verbindungen des Typs 3 und 4, typischerweise Amino-N-oxide, werden durch eine einzige dipolare Struktur befriedigend dargestellt. Für die Heterocyclen des Typs 5 und 6 gibt keine eindeutig bevorzugte mesomere Grenzstruktur. Dies sind die Verbindungen, die in der Literatur als mesoionische Verbindungen des Typs A (5) und des Typs B (6) bezeichnet werden.[10]
Mesoionische Heterocyclen vom Typ A
Die meisten mesoionischen Verbindungen gehören zum Typ A. Die bekanntesten Vertreter sind die Sydnone und die Münchnone.[10][9]
| Mesoionische Verbindungen vom Typ A | |||||
|---|---|---|---|---|---|
| Heterocyclische Grundstruktur | Vertreter | Struktur | Heterocyclische Grundstruktur | Vertreter | Struktur |
| 1,3-Dioxol[11] | 1,3-Dioxolium-4-olate |  |
1,3-Oxazol | 1,3-Oxazolium-5-olate Münchnone |
 |
| 1,3-Oxathiol | 1,3-Oxathiolium-4-olate |  |
1,3-Oxazolium-4-olate Isomünchnone |
 | |
| 1,3-Selenazol | 1,3-Selenazolium-4-olate |  |
Imidazol | 1,3-Diazolium-4-olate |  |
| 1,3-Oxathiol | 1,3-Oxathiolium-4-olate |  |
1,3-Thiazol | 1,3-Thiazolium-4-olate |  |
| 1,3-Dithiol[12] | 1,3-Dithiolium-4-olate |  |
1,3-Thiazolium-5-olate |  | |
| 1,2,3-Oxadiazol | 1,2,3-Oxadiazolium-5-olates Sydnone |
 |
1,3,4-Oxadiazol | 1,3,4-Oxadiazolium-2-olate |  |
| 1,2,3-Oxadiazolium-5-thiolate |  |
1,2,3-Triazol | 1,2,3-Triazolium-4-olate | 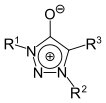 | |
| 1,2,3-Oxadiazolium-5-aminide |  |
Tetrazol | 1,2,3,4-Tetrazolium-5-olate |  | |
Mesoionische Heterocyclen vom Typ B
| Mesoionische Verbindungen vom Typ B | |||||
|---|---|---|---|---|---|
| Heterocyclische Grundstruktur | Vertreter | Struktur | Heterocyclische Grundstruktur | Vertreter | Struktur |
| 1,2-Oxazol | 1,2-Oxazolium-4-olate |  |
Pyrazol | 1,2-Diazolium-4-olate |  |
| Isothiazol | 1,2-Thiazolium-4-olate |  |
1,2-Dithiol[13] | 1,2-Dithiolium-4-olate |  |
| 1,2,5-Thiadiazol | 1,2,5-Thiadiazolium-3-olate |  |
Tetrazol | 1,2,3,4-Tetrazolium-5-thiolate | 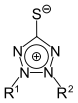 |
Eigenschaften
Die Formulierung der mesoionischen Verbindungen als Fünfring mit einer delokalisierten positiven Ladung und einem negativ geladenen Substituenten, wie beispielsweise Struktur 1 bei den Münchnonen, legt den aromatischen Charakter dieser Verbindungen nahe.

Jedoch zeigen sowohl theoretische Berechnungen, als auch röntgenkristallografische und NMR-spektroskopische Untersuchungen, dass die nichtaromatische Struktur 2 mit getrennten positiv und negativ geladenen Bereichen die Verbindungen besser beschreibt.[14]
Der wichtigste Reaktionstyp der mesoionischen Verbindungen ist die 1,3-Dipolare Cycloaddition.[1]

So erhält man durch die thermische Umsetzung von Alkinen 1 mit Sydnonen 2 die bicyclische Zwischenstufen 3a/3b. In einer Retro-Diels-Alder-Reaktion bilden sich durch Abspaltung von Kohlendioxid die Pyrazole 4a/4b.[15] Diese Reaktion verläuft nicht regioselektiv. Die Kupfer katalysierte Sydnon-Alkin Cycloaddition verläuft unter wesentlich milderen Bedingungen und mit einer hohen Selektivität.[16] Neben den Pyrazolen sind durch eine 1,3-Dipolare Cycloaddition mesoionischer Heterocyclen mit Alkenen und Alkinen auch Pyrrole und Furane zugänglich.[17]
Sydnone können in der 4-Position durch metallorganische Verbindungen wie Lithiumorganische Verbindungen oder Grignard-Verbindungen deprotoniert werden. Durch Reaktion mit verschiedenen Reagenzien sind über die metallierten Sydnone verschiedene substituierte Sydnone zugänglich.


Die metallierten Sydnone sind ausreichend stabil um sie isolieren zu können. Dies ist bei den Münchnonen nicht der Fall.[17]
Einzelnachweise
- Eintrag zu mesoionische Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. April 2021.
- Wilson Baker, W. D. Ollis, V. D. Poole: 73. Cyclic meso-ionic compounds. Part I. The structure of the sydnones and related compounds. In: Journal of the Chemical Society. 1949, S. 307–314, doi:10.1039/jr9490000307.
- Emil Fischer: Ueber die Hydrazinverbindungen. In: Justus Liebigs Annalen der Chemie. Band 212, Nr. 3, 1882, S. 316–339, doi:10.1002/jlac.18822120303.
- Eug. Bamberger, Rob. Padova, Ernest Ormerod: Über Nitro- und Amino-formazyl. In: Justus Liebig’s Annalen der Chemie. Band 446, Nr. 1, 1926, S. 260–307, doi:10.1002/jlac.19264460116.
- James W. Ogilvie, Alsoph H. Corwin: The Structure of Dehydrodithizone: A Novel Synthesis of Tetrazolium Salts. In: Journal of the American Chemical Society. Band 83, Nr. 24, 1. Dezember 1961, S. 5023–5027, doi:10.1021/ja01485a033.
- Yoshihiko Kushi, Quintus Fernando: The crystal and molecular structure of dehydrodithizone. In: Journal of the Chemical Society D: Chemical Communications. Nr. 21, 1969, S. 1240, doi:10.1039/c2969001240b.
- R. S. Ramakrishna, H. M. N. H. Irving: The non-existence of selenium dithiozonate. In: Journal of the Chemical Society D: Chemical Communications. Nr. 23, 1969, S. 1356, doi:10.1039/c29690001356.
- c, Alan W. Mackney: 204. The action of acetic anhydride on N-nitrosophenylglycine and some of its derivatives. In: Journal of the Chemical Society (Resumed). 1935, S. 899, doi:10.1039/jr9350000899.
- Christopher G. Newton, Christopher A. Ramsden: Meso-ionic heterocycles (1976–1980). In: Tetrahedron. Band 38, Nr. 20, Januar 1982, S. 2965–3011, doi:10.1016/0040-4020(82)80186-5.
- W. David Ollis, Christopher A. Ramsden: Meso-ionic Compounds. In: Advances in Heterocyclic Chemistry. Band 19. Elsevier, 1976, S. 1–122, doi:10.1016/S0065-2725(08)60230-5.
- Externe Identifikatoren von bzw. Datenbank-Links zu 1,3-Dioxol: CAS-Nummer: 288-53-9, PubChem: 11029757, ChemSpider: 9204931, Wikidata: Q82273029.
- Externe Identifikatoren von bzw. Datenbank-Links zu 1,3-Dithiol: CAS-Nummer: 288-74-4, PubChem: 5316944, ChemSpider: 4475898, Wikidata: Q55829846.
- Externe Identifikatoren von bzw. Datenbank-Links zu 1,2-Dithiol: CAS-Nummer: 288-26-6, PubChem: 525331, ChemSpider: 457993, Wikidata: Q18343387.
- Alfredo Mayall Simas, Joseph Miller, Petrônio Filgueiras de Athayade Filho: Are mesoionic compounds aromatic? In: Canadian Journal of Chemistry. Band 76, Nr. 6, 1. Juni 1998, S. 869, doi:10.1139/v98-065.
- R. Huisgen, R. Grashey, H. Gotthardt, Renate Schmidt: 1.3-Dipolare Additionen der Sydnone an Alkine. Ein neuer Weg in die Pyrazol-Reihe. In: Angewandte Chemie. Band 74, Nr. 1, 7. Januar 1962, S. 29–30, doi:10.1002/ange.19620740109.
- Elodie Decuypère, Lucie Plougastel, Davide Audisio, Frédéric Taran: Sydnone–alkyne cycloaddition: applications in synthesis and bioconjugation. In: Chemical Communications. Band 53, Nr. 84, 2017, S. 11515, doi:10.1039/C7CC06405E.
- Justin M. Lopchuk: Mesoionics. In: Topics in Heterocyclic Chemistry. Band 29. Springer Verlag, Berlin, Heidelberg 2012, S. 381–414, doi:10.1007/7081_2012_83.