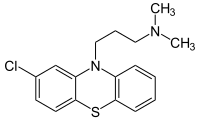
Chlorpromazin
Chlorpromazin ist ein Phenothiazin-Derivat und ein Neuroleptikum von mittlerer Potenz. Chlorpromazin war der erste Arzneistoff aus der Gruppe der Neuroleptika und gilt als Grundstein der modernen Psychopharmaka-Therapie. Wie die später entwickelten Neuroleptika kann Chlorpromazin extrapyramidal-motorische Störungen verursachen. Um die antipsychotische Wirkungsstärke der Neuroleptika miteinander zu vergleichen, wurde die neuroleptische Potenz eingeführt. Die neuroleptische Potenz ist ein Maß für die antipsychotische Wirksamkeit eines Neuroleptikums. Als Vergleichswert wurde der Potenz von Chlorpromazin der Wert 1 zugeordnet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Chlorpromazin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C17H19ClN2S | |||||||||||||||||||||
| Kurzbeschreibung |
ölige Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05AA01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 318,86 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| pKS-Wert |
9,3 (25 °C)[2] | |||||||||||||||||||||
| Löslichkeit |
Wasser: 2,55 mg·l−1 (24 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Ausgangspunkt der Entwicklung der „Neuroleptika“ vom Phenothiazintyp war die deutsche Farbstoffindustrie um 1900. Die „Badische Anilin und Sodafabrik“ BASF stellte chemische Farbstoffe her, die bald auch in der Histologie Verwendung fanden. Bald stellte man auch eine antibiotische Wirksamkeit von bestimmten Farbstoffen fest. Einige historische Beispiele sind:
- Trypanrot gegen Trypanosomen (Schlafkrankheit)
- Arsphenamin gegen Syphilis (P. Ehrlich „Salvarsan“)
- Methylenblau, ein Phenothiazin-Derivat, getestet gegen Malaria.
Vor allem Malariamedikamente waren im Zweiten Weltkrieg knapp, da der einzige wirksame Stoff Chinin noch aus dem Chinarindenbaum gewonnen werden musste. Bei Anwendung der Phenothiazinderivate wie Promethazin (1948; als Atosil bis heute im Handel) stellte man rasch eine sedierende und antihistaminerge Wirkung fest. Dies sollte bei kriegsbedingten Schock- und Stressreaktionen und bei Operationen von Vorteil sein. Die zusätzlichen vegetativen (sympathiko- und vagolytischen) Eigenschaften wurden als „künstlicher Winterschlaf“ bezeichnet und sollten bei größeren Operationen hilfreich sein. Zusammen mit Opiaten wurde damals von „Neuroleptanästhesie“ gesprochen. Bald wurde festgestellt, dass die Substanzen eine deutlich antipsychotische Wirksamkeit hatten. Die ersten klinischen Erfahrungen wurden vor allem in Frankreich, Belgien und der Schweiz gemacht. In den USA erfolgte die Ausbreitung nur langsam durch die damalige starke Verbreitung der Psychoanalyse.[4]
Chlorpromazin wurde 1950 von dem Chemiker Paul Charpentier bei der Firma Rhône-Poulenc synthetisiert. Es zeigte sich, dass Chlorpromazin neben einem antihistaminischen Effekt eine stark sedierende Wirkung hat. Zwischen April 1951 und März 1952 wurden 4000 Proben an über 100 Forscher in 9 Länder verschickt. Am 13. Oktober 1951 erschien der erste Artikel, in dem Chlorpromazin öffentlich erwähnt wurde. Henri Marie Laborit berichtete über Erfolge mit der neuen Substanz bei der Anästhesie. Die beiden französischen Psychiater Jean Delay und Pierre Deniker gaben am 26. Mai 1952 bekannt, dass sie eine beruhigende Wirkung bei Patienten mit Manie gesehen hätten. Während Chlorpromazin am Anfang noch gegen viele verschiedene Störungen eingesetzt wurde, zeigte sich später als wichtigste Indikation die Schizophrenie. Von einigen Forschern wurde sogar eine spezifische Wirkung gegen diese Erkrankung angenommen.
Ab 1953 wurde das Chlorpromazin als Megaphen (Deutschland 1. Juli 1953) oder Largactil in Europa vermarktet, 1955 kam es in den USA unter dem Namen „Thorazine“ auf den Markt.
Nach der Einführung von Chlorpromazin kam es zu einer deutlichen Abnahme von Betten in psychiatrischen Krankenhäusern. In den USA war die Zahl bis 1955 kontinuierlich angestiegen, danach sank sie innerhalb weniger Jahre auf die Hälfte. In welchem Maß die Neuroleptika zu dieser Entwicklung beigetragen haben, ist jedoch schwer zu beurteilen, da in den 1950er und 1960er Jahren auch die Psycho- und Soziotherapie stark verbessert wurden.[5]
1988 wurde Megaphen vom westdeutschen Markt genommen. Die deutschen Ärzte bevorzugten schon länger Perazin als Mittel bei Schizophrenie. Hingegen wurde in den USA, wo der Markenname Thorazine als Synonym für ein starkes Beruhigungsmittel in den Wortschatz eingegangen ist, Chlorpromazin weiter häufig angewendet. 1989 erschienen in den Fachzeitschriften ganzseitige Anzeigen mit dem Slogan „Trust 35 Years of Proven Experience – Thorazine“.[6]
Bis heute steht Chlorpromazin auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation.
Pharmakologie
Infolge der Blockade verschiedener Neurotransmitter-Rezeptoren ist das Wirkungsspektrum von Chlorpromazin sehr breit.[7] Es wirkt antipsychotisch, sedierend, antiemetisch, lokalanästhetisch, ganglienblockierend, anticholinerg, antiadrenerg und antihistaminisch. Die mittlere Tagesdosis beträgt meist deutlich unter 400 mg, bei akuten schizophrenen Psychosen werden Dosen von über 400 mg eingesetzt.[8] Die absolute Bioverfügbarkeit bei oraler Gabe beträgt 30 Prozent, die Halbwertszeit beträgt 30 Stunden. Mehr als 75 Metabolite sind bekannt, ein aktiver Metabolit ist 7-Hydroxy-Chlorpromazin, das eine Halbwertszeit von 24 Stunden hat.
Chlorpromazin wirkt über eine reversible Blockade des D1- und D2-Subtyps der Dopamin-Rezeptoren.[9] Chlorpromazin wirkt zudem als FIASMA (funktioneller Hemmer der sauren Sphingomyelinase).[10]
Unerwünschte Wirkungen
Die wichtigsten Nebenwirkungen von Chlorpromazin sind Sedation und Senkung des Blutdrucks (Hypotonie).
Durch Beeinflussung des Wärmezentrums wird die Wärmeregulation gestört, wodurch bei niedrigen Temperaturen eine Hypothermie, bei hohen Temperaturen eine Hyperthermie ausgelöst werden kann. Des Weiteren kann es nach Gabe von Chlorpromazin zu allergischen Hautreaktionen und Leberfunktionsstörungen kommen. Selten beobachtet wird eine cholestatische Hepatose, die zum Tode führen kann.
Ferner werden Photosensibilität, Thrombosen, Menstruations- und Potenzstörungen, Leukopenie sowie ausgeprägte anticholinerge Wirkungen beschrieben. Sehr selten kommt es zu Agranulozytose.
Ein Extrapyramidales Syndrom wird durch Chlorpromazin im Vergleich zu den hochpotenten Neuroleptika deutlich seltener ausgelöst.
Biotransformation
Phenothiazine können eine große Zahl an Metaboliten bilden. Das Ringsystem kann hydroxyliert, die Seitenkette kann zunächst hydroxyliert, dann mit Glucuronsäure konjugiert werden. Das tertiäre Amin kann N-desalkyliert und das sulfidische Schwefel-Atom zum Sulfoxid oxidiert werden.
Synthese
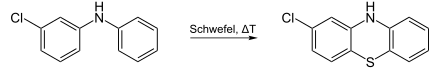
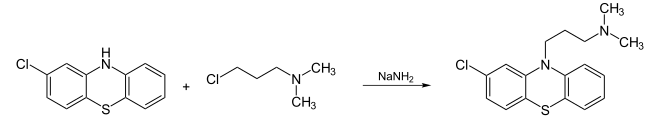
Ausgehend vom 3-Chlordiphenylamin wird durch Erhitzen mit Schwefel 2-Chlorphenothiazin erhalten. 3-Dimethylaminopropylchlorid alkyliert das Phenothiazin-Derivat im Basischen zu Chlorpromazin.
Analytik
Durch Oxidation entsteht aus Chlorpromazin eine farbige Verbindung. Die Gehaltsbestimmung kann gegen Perchlorsäure in Eisessig erfolgen. Als Endpunkterkennung bietet sich eine potentiometrische Messung ebenso wie Kristallviolett als Indikator an.
Anwendungsverbot
Die Anwendung von Chlorpromazin ist bei Lebensmittel liefernden Tieren gemäß der EU-Rückstandshöchstmengen-Verordnung für Lebensmittel tierischen Ursprungs in der Europäischen Union generell verboten.
Handelsnamen
Monopräparate
Largactil (Frankreich), Fenactil (PL), Thorazine (USA, GB). Megaphen war das einzige in Deutschland erhältliche Chlorpromazin-Präparat, wurde jedoch ersatzlos vom Markt genommen.
Siehe auch
Literatur
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4.
- Judith Swazey: Chlorpromazine in Psychiatry. Cambridge 1974, ISBN 0-262-19130-X (Eines der ersten und besten Bücher zur Geschichte der modernen Psychopharmaka).
- Khaled Selim, Neil Kaplowitz: Hepatotoxicity of psychotropic drugs. In: Hepatology. Band 29, Nr. 5, Mai 1999, S. 1347–1351, doi:10.1002/hep.510290535.
Weblinks
- Chlorpromazin. In: Erowid. (englisch)
Einzelnachweise
- Eintrag zu Chlorpromazin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- Eintrag zu Chlorpromazine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021. (Seite nicht mehr abrufbar)
- Eintrag zu 2-Chlor-10-(3-(dimethylamino)propyl)phenothiazin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- F. López-Muñoz, C. Alamo, E. Cuenca, W. W. Shen, P. Clervoy, G. Rubio: History of the discovery and clinical introduction of chlorpromazine. In: Annals of Clinical Psychiatry: Official Journal of the American Academy of Clinical Psychiatrists. Band 17, Nr. 3, 2005, S. 113–135, PMID 16433053.
- Hans C. Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. VWB, Berlin 1992, ISBN 3-927408-82-4, S. 103
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4, S. 104.
- C. E. Adams, G. A. Awad, J. Rathbone, B. Thornley, K. Soares-Weiser: Chlorpromazine versus placebo for schizophrenia. In: The Cochrane database of systematic reviews. Band 1, 2014, S. CD000284, doi:10.1002/14651858.CD000284.pub3. PMID 24395698.
- X. Liu, S. De Haan: Chlorpromazine dose for people with schizophrenia. In: The Cochrane database of systematic reviews. Nummer 2, 2009, S. CD007778; doi:10.1002/14651858.CD007778. PMID 19370692.
- A. J. Giannini, C. Nageotte, R. H. Loiselle, D. A. Malone, W. A. Price: Comparison of chlorpromazine, haloperidol and pimozide in the treatment of phencyclidine psychosis: DA-2 receptor specificity. In: Journal of toxicology. Clinical toxicology. Band 22, Nummer 6, 1984–1985, S. 573–579. PMID 6535849.
- J. Kornhuber, M. Muehlbacher, S. Trapp, S. Pechmann, A. Friedl, M. Reichel, C. Mühle, L. Terfloth, T. Groemer, G. Spitzer, K. Liedl, E. Gulbins, P. Tripal: Identification of novel functional inhibitors of acid sphingomyelinase. In: PLoS ONE. Band 6, Nr. 8, 2011, S. e23852, doi:10.1371/journal.pone.0023852.