Mangafodipir
Mangafodipir, als Abkürzung Mn-DPDP, ist der internationale Freiname eines Kontrastmittels für die Magnetresonanztomographie (MRT), auf der Basis von zweiwertigem Mangan. Es wird unter dem Markennamen Teslascan von GE Healthcare vertrieben.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
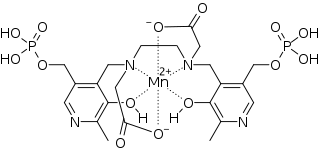 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Mangafodipir | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C22H28MnN4O14P2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
V08CA05 | |||||||||||||||
| Wirkstoffklasse |
Paramagnetisches Kontrastmittel | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 689,36 g·mol−1 als Mn-DPDP | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Indikation und Anwendung
Die Anwendung von Mangafodipir als Kontrastmittel in der Kernspintomografie ist im Wesentlichen bei Läsionen der Leber indiziert. Darüber hinaus kann es auch bei Läsionen der Bauchspeicheldrüse eingesetzt werden. In vielen Fällen wird es zur Diagnose von Lebermetastasen verwendet. Auch nicht maligne Veränderungen, wie beispielsweise der Bauchspeicheldrüse beim Caroli-Syndrom,[2] können mit Hilfe dieses Kontrastmittels besser diagnostiziert werden.
Die Substanz wird vor der MRT intravenös verabreicht. Nach etwa 15 bis 20 Minuten wird das Maximum der Anreicherung im Parenchym der Leber erreicht und für etwa vier Stunden gehalten.[3]
In der Europäischen Union beträgt die dem Patienten verabreichte Dosis üblicherweise 0,5 ml pro Kilogramm Körpergewicht.[4]
Aufbau und Wirkprinzip des Kontrastmittels
Mangan2+-Ionen haben auf ihrer äußeren Elektronenschale fünf ungepaarte Elektronen,[5] wodurch sie stark paramagnetisch sind. Freie Manganionen sind bei der intravenösen Applikation für den Menschen und sehr viele andere Organismen neurotoxisch und schädigen das Zentralnervensystem.[6] Durch die Komplexierung mit einem Chelator kann die Toxizität jedoch drastisch reduziert werden. Im Fall von Mangafodipir wird Dipyridoxyldiphosphat (DPDP bzw. Fodipir), ein Komplexbildner auf der Basis von zwei Molekülen Pyridoxin (Vitamin B6), verwendet.
Als Kontrastmittel verkürzen Mangan2+-Ionen die T1-Relaxationszeit, weshalb T1-gewichtete Bilder bei der Kernspintomografie an den Stellen, an denen sich Mangafodipir angereichert hat, heller erscheinen. Mangafodipir wird spezifisch von den Hepatozyten in der Leber aufgenommen. Lebermetastasen werden von anderen Zelltypen gebildet, die Mangafodipir nicht aufnehmen können. Auf diese Weise verstärkt Mangafodipir den Kontrast bei der Kernspintomographie: die Lebermetastasen erscheinen in T1-gewichteten Aufnahmen deutlich dunkler als das gesunde Lebergewebe. Bei T2-gewichteten Aufnahmen ist diese Kontrastverstärkung durch Mangafodipir nicht gegeben.[7]
Pharmakokinetik
Mangafodipir wird durch Dephosphorylisierung verstoffwechselt, wobei die Manganionen durch Austausch mit Zink-Ionen im Plasma freigesetzt werden. Das so freigesetzte Mangan wird unmittelbar beim ersten Passieren der Leber aufgenommen, weshalb es seine neurotoxische Wirkung nicht entfalten kann.[6]
Das freigesetzte Mangan und das Dipyridoxyldiphosphat werden unterschiedlich aus dem Körper ausgeschieden. Die mittlere initiale Plasmahalbwertszeit der Manganionen beträgt weniger als 20 Minuten. Sie werden im Wesentlichen von der Leber, der Bauchspeicheldrüse, den Nieren und der Milz aufgenommen. Die initiale Plasmahalbwertszeit des Liganden beträgt etwa 50 Minuten. Er wird innerhalb von 24 Stunden nahezu vollständig über den Urin und zu einem geringen Teil über den Stuhl ausgeschieden. Dagegen wird in den ersten 24 Stunden nur etwa 15 bis 20 Prozent des Mangans über den Urin eliminiert. Der größte Anteil des verbleibenden Restes wird in den folgenden vier Tagen über den Stuhl ausgeschieden.[3]
Nebenwirkungen
An unerwünschten Nebenwirkungen stellen sich nach der Verabreichung von Mangafodipir am häufigsten Kopfschmerzen, Übelkeit, Rötungen der Haut und ein Hitzegefühl ein. Davon sind etwa 1 bis 10 % der Patienten betroffen.[4]
Bei schwangeren oder stillenden Patientinnen darf Mangafodipir nicht angewendet werden, ebenso nicht bei Patienten mit einem Phäochromozytom oder schweren Leber- und Nierenerkrankungen.[3][4]
Im Modellorganismus Farbratte konnte bei einer Dosis, die etwas höher als die klinisch üblichen Dosen liegt, eine teratogene Wirkung festgestellt werden. Die Rattenfeten zeigten verstärkt Missbildungen am Skelettsystem.[3]
Therapeutische Wirkungen
Als Kontrastmittel sollte Mangafodipir lediglich diagnostische Eigenschaften und keine Nebenwirkungen oder therapeutischen Eigenschaften haben. Mangafodipir zeigt in verschiedenen Modellorganismen jedoch auch therapeutische Effekte. Es schützt beispielsweise das Myokard gegen oxidativen Stress, der durch reaktive Sauerstoffspezies ausgelöst wird. Es stabilisiert die lysosomalen und mitochondionalen Membranen und verhindert so die Apoptose.[8]
Darüber hinaus zeigt Mangafodipir im Tierversuch eine Anti-Tumor-[9] und eine die Leber schützende Wirkung.[10][11] So konnte beispielsweise bei Farbmäusen die Überlebensrate, bei durch Paracetamol induziertem akutem Leberversagen, präventiv und kurativ verbessert werden.[10]
Mangafodipir hat in vivo offensichtlich eine ähnliche Wirkung wie Superoxiddismutasen.[12]
Für therapeutische Anwendungen ist Mangafodipir nicht zugelassen.
Entwicklungsgeschichte
Mangafodipir wurde zu Beginn der 1980er Jahre entwickelt. Die ersten klinischen Studien fanden in den frühen 1990er Jahren statt. Die Europäische Kommission erteilte am 22. Mai 1997 GE Healthcare die Arzneimittelzulassung.[13]
Weiterführende Literatur
- S. Maurea, C. Mollica, M. Imbriaco, M. Fusari, L. Camera, M. Salvatore: Magnetic resonance cholangiography with mangafodipir trisodium in Caroli's disease with pancreas involvement. In: Journal of the pancreas Band 11, Nummer 5, 2010, S. 460–463, PMID 20818116.
- S. N. Gandhi, M. A. Brown, J. G. Wong, D. A. Aguirre, C. B. Sirlin: MR contrast agents for liver imaging: what, when, how. In: Radiographics : a review publication of the Radiological Society of North America, Inc Band 26, Nummer 6, 2006 Nov-Dec, S. 1621–1636, doi:10.1148/rg.266065014, PMID 17102040.
- B. M. Yeh, R. S. Breiman, B. Taouli, A. Qayyum, J. P. Roberts, F. V. Coakley: Biliary tract depiction in living potential liver donors: comparison of conventional MR, mangafodipir trisodium-enhanced excretory MR, and multi-detector row CT cholangiography–initial experience. In: Radiology Band 230, Nummer 3, März 2004, S. 645–651, doi:10.1148/radiol.2303021775, PMID 14990830.
- W. Schima, R. Függer: Evaluation of focal pancreatic masses: comparison of mangafodipir-enhanced MR imaging and contrast-enhanced helical CT. In: European radiology Band 12, Nummer 12, Dezember 2002, S. 2998–3008, doi:10.1007/s00330-002-1531-y, PMID 12439582.
- M. P. Federle, J. L. Chezmar, D. L. Rubin, J. C. Weinreb, P. C. Freeny, R. C. Semelka, J. J. Brown, J. A. Borello, J. K. Lee, R. Mattrey, A. H. Dachman, S. Saini, B. Harmon, M. Fenstermacher, R. E. Pelsang, S. E. Harms, D. G. Mitchell, H. H. Halford, M. W. Anderson, C. D. Johnson, I. R. Francis, J. G. Bova, P. J. Kenney, D. L. Klippenstein, G. S. Foster, D. A. Turner: Safety and efficacy of mangafodipir trisodium (MnDPDP) injection for hepatic MRI in adults: results of the U.S. multicenter phase III clinical trials (safety). In: Journal of magnetic resonance imaging : JMRI Band 12, Nummer 1, Juli 2000, S. 186–197, PMID 10931579.
- M. Federle, J. Chezmar, D. L. Rubin, J. Weinreb, P. Freeny, U. P. Schmiedl, u. a.: Efficacy and safety of mangafodipir trisodium (MnDPDP) injection for hepatic MRI in adults: results of the U.S. Multicenter phase III clinical trials. Efficacy of early imaging. In: Journal of magnetic resonance imaging Band 12, Nummer 5, November 2000, S. 689–701, PMID 11050638.
- D. Mathieu, C. Coffin, H. Kobeiter, F. Caseiro-Alves, A. Mahfouz, A. Rahmouni, T. Diche: Unexpected MR-T1 enhancement of endocrine liver metastases with mangafodipir. In: Journal of magnetic resonance imaging : JMRI Band 10, Nummer 2, August 1999, S. 193–195, PMID 10441024.
- P. Jynge, H. Brurok, A. Asplund, R. Towart, H. Refsum, J. O. Karlsson: Cardiovascular safety of MnDPDP and MnCl2. In: Acta radiologica (Stockholm, Sweden : 1987) Band 38, Nummer 4 Pt 2, Juli 1997, S. 740–749, PMID 9245970.
- Y. Ni, G. Marchal: Clinical implications of studies with MnDPDP in animal models of hepatic abnormalities. In: Acta radiologica (Stockholm, Sweden : 1987) Band 38, Nummer 4 Pt 2, Juli 1997, S. 724–731, PMID 9245968.
- N. M. Rofsky, J. P. Earls: Mangafodipir trisodium injection (Mn-DPDP). A contrast agent for abdominal MR imaging. In: Magnetic resonance imaging clinics of North America Band 4, Nummer 1, Februar 1996, S. 73–85, PMID 8673718.
Weblinks
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- S. Maurea, C. Mollica, M. Imbriaco, M. Fusari, L. Camera, M. Salvatore: Magnetic resonance cholangiography with mangafodipir trisodium in Caroli's disease with pancreas involvement. In: Journal of the pancreas Band 11, Nummer 5, 2010, S. 460–463, PMID 20818116.
- New Zealand Medicines and Medical Devices Safety Authority: TESLASCAN - Mangafodipir trisodium (Memento vom 7. Februar 2013 im Internet Archive). Abgerufen am 8. Juli 2011.
- Europäischer Öffentlicher Beurteilungsbericht (EPAR) – TESLASCAN – Zusammenfassung des EPAR für die Öffentlichkeit. (PDF; 285 kB) European Medicines Agency, April 2007
- Die Elixiere des Lebens. (Memento vom 11. April 2011 im Internet Archive) (PDF; 1,1 MB) In: MaxPlanckForschung 3, 2003, S. 47–51.
- J. Crossgrove, W. Zheng: Manganese toxicity upon overexposure. In: NMR in biomedicine Band 17, Nummer 8, Dezember 2004, S. 544–553, doi:10.1002/nbm.931. PMID 15617053. (Review).
- mr-tip.com: Teslascan. Abgerufen am 8. Juli 2011
- A. Laskar, S. Miah, R. G. Andersson, W. Li: Prevention of 7β-hydroxycholesterol-induced cell death by mangafodipir is mediated through lysosomal and mitochondrial pathways. In: European journal of pharmacology Band 640, Nummer 1–3, August 2010, S. 124–128, doi:10.1016/j.ejphar.2010.04.046. PMID 20452343.
- A. Laurent, C. Nicco, C. Chéreau, C. Goulvestre, J. Alexandre, A. Alves, E. Lévy, F. Goldwasser, Y. Panis, O. Soubrane, B. Weill, F. Batteux: Controlling tumor growth by modulating endogenous production of reactive oxygen species. In: Cancer Research Band 65, Nummer 3, Februar 2005, S. 948–956, PMID 15705895.
- S. Bedda, A. Laurent, F. Conti, C. Chéreau, A. Tran, J. Tran-Van Nhieu, P. Jaffray, O. Soubrane, C. Goulvestre, Y. Calmus, B. Weill, F. Batteux: Mangafodipir prevents liver injury induced by acetaminophen in the mouse. In: Journal of Hepatology Band 39, Nummer 5, November 2003, S. 765–772, PMID 14568259.
- J. O. Karlsson, H. Brurok, R. Towart, P. Jynge: The magnetic resonance imaging contrast agent mangafodipir exerts antitumor activity via a previously described superoxide dismutase mimetic activity. In: Cancer research Band 66, Nummer 1, Januar 2006, S. 598; author reply 598, doi:10.1158/0008-5472.CAN-05-2053. PMID 16397277.
- H. Brurok, J. H. Ardenkjaer-Larsen, G. Hansson, S. Skarra, K. Berg, J. O. Karlsson, I. Laursen, P. Jynge: Manganese dipyridoxyl diphosphate: MRI contrast agent with antioxidative and cardioprotective properties? In: Biochemical and biophysical research communications Band 254, Nummer 3, Januar 1999, S. 768–772, PMID 9920816.
- Diagnosia: Teslascan 0,01 mmol/ml Infusionslösung. (Memento vom 23. Februar 2014 im Internet Archive) Abgerufen am 9. Juli 2011.