Malonsäuredinitril
Malonsäuredinitril, auch Propandinitril, ist eine chemische Verbindung aus der Stoffklasse der Nitrile mit der Formel CH2(CN)2. Malonsäuredinitril ist relativ sauer mit einem pKs-Wert von 11 in Wasser.[7] Daher kann Malonsäuredinitril in einer Knoevenagel-Kondensation reagieren, zum Beispiel zur Herstellung von 2-Chlorbenzyliden-malonsäuredinitril.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
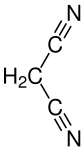 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Malonsäuredinitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H2N2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 66,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,049 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
220 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4146 (34 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
186,4 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Malonsäuredinitril kann aus Chlorcyanoacetylen[S 1] und Ammoniak hergestellt werden.[8] Im großtechnischen Maßstab wird Malonsäuredinitril bei der Umsetzung von Acetonitril mit Chlorcyan bei über 700 °C hergestellt. Andere Möglichkeiten zur Herstellung gehen von (2-Cyano-N-alkoxy)-acetimidoylhalogeniden aus, wobei ebenfalls Temperaturen zwischen 500 und 1000 °C benötigt werden.[9]
Eigenschaften
Malonitril ist ein brennbarer farbloser Feststoff, der leicht löslich in Wasser ist. Er zersetzt sich ab einer Temperatur von 130 °C, wobei Cyanwasserstoff, Stickstoffoxide, Kohlenmonoxid und Kohlendioxid entstehen und eine Explosion möglich ist.[2] Die mittels DSC bestimmte Zersetzungswärme beträgt −108 kJ·mol−1 bzw. −1650 kJ·kg−1.[10] Bei niedrigeren Temperaturen kann es bei Kontakt mit starken Basen zu einer heftigen Polymerisation kommen, die ebenfalls explosionsartig verlaufen kann.[11]
Verwendung
In der Chemie ist Malonsäuredinitril ein Ausgangsmaterial für die Gewald-Reaktion, in welcher das Nitril mit einem Keton oder Aldehyd in Gegenwart von elementarem Schwefel und einer Base zu 2-Aminothiophenen[S 2] kondensiert. Weiterhin spielt Malonsäuredinitril eine wichtige Rolle bei der Synthese einer Vielfalt von pharmazeutischen und agrochemischen Wirkstoffen.[12] Malonsäuredinitril ist ein Edukt für die Gewinnung von CS-Gas.
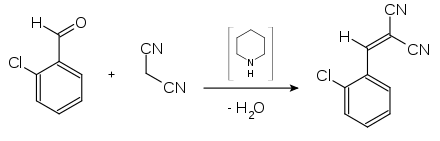
- Synthese von 2-Chlorbenzyliden-malonsäuredinitril (CS-Gas)
Einzelnachweise
- Eintrag zu Malononitril. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Juli 2016.
- Eintrag zu Malonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-322.
- Eintrag zu Malononitrile im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Malonsäuredinitril bei Merck, abgerufen am 19. Januar 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- Evans pKa table (Memento des vom 19. Juni 2018 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 245 kB)
- Peter B. Sargeant: Fluorocyclopropanes. I. Preparation and nuclear magnetic resonance spectra. In: The Journal of Organic Chemistry. Band 35, Nr. 3, März 1970, S. 678–682, doi:10.1021/jo00828a029 (Eigentlich geht es in dem Artikel um etwas ganz anderes. Die Synthese von Malonitril ist nur vom vorherigen Artikel mit auf der Seite. Den Artikel hab ich aber auf die Schnelle nicht gefunden.).
- Process for the preparation of malononitrile
- T. Grewer, O. Klais: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften. (= Humanisierung des Arbeitslebens. Band 84). VDI-Verlag, Düsseldorf 1988, ISBN 3-18-400855-X, S. 8.
- Bretherick's Handbook of Reactive Chemical Hazards. 6. Auflage. Vol. 1, Butherworth-Heinemann, 1999, ISBN 0-7506-3605-X, S. 386.
- Ullmanns Encyklopädie der technischen Chemie. 4., neubearbeitete und erweiterte Auflage. Band 16, Verlag Chemie, Weinheim 1978, ISBN 3-527-20016-9, S. 419–423.

