Magnesiumperchlorat
Magnesiumperchlorat ist das Magnesiumsalz der Perchlorsäure HClO4. Es ist ein chemischer Feststoff mit der Formel Mg(ClO4)2.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
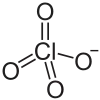 | ||||||||||
| Allgemeines | ||||||||||
| Name | Magnesiumperchlorat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | Mg(ClO4)2 | |||||||||
| Kurzbeschreibung |
weißes, geruchloses Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse |
| |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
2,60 g·cm−3 (25 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
sehr gut in Wasser (ca. 1000 g·l−1 bei 25 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Eigenschaften
Magnesiumperchlorat ist ein starkes Oxidationsmittel und gibt beim Erhitzen Sauerstoff ab. Deshalb ist es stark brandfördernd. Mit brennbaren Verbindungen bildet Magnesiumperchlorat explosive Mischungen, die schlagempfindlich sind und gegebenenfalls bereits beim Vermengen detonieren. Die Herstellung solcher Mischungen verbietet sich daher von selbst. Magnesiumperchlorat, das mehr als 2 % brennbare Verunreinigungen enthält, fällt unter das Sprengstoffgesetz.[2]
Magnesiumperchlorat ist äußerst hygroskopisch. Der Wasserdampf-Partialdruck über wasserfreiem Magnesiumperchlorat (sogenanntes Anhydron) beträgt lediglich 70 mPa, der über dem Dihydrat (Mg(ClO4)2·2H2O, Dehydrit) 300 mPa bei 20 °C (zum Vergleich: 3 mPa über Phosphor(V)-oxid). Es wird daher als Trockenmittel für nicht oxidierbare Stoffe verwendet, da es zudem auch eine hohe Trockenkapazität besitzt. Die Wasserabsorption ist ein sehr exothermer Prozess.
Magnesiumperchlorat ist in Wasser und polaren organischen Lösungsmitteln gut löslich.[3]
Löslichkeit in verschiedenen Lösungsmitteln bei 25 °C[3][4] Lösungsmittel Wasser Methanol Ethanol n-Propanol Aceton Ethylacetat Diethylether Löslichkeit in g/100 g Lösungsmittel 99,601 51,838 23,962 73,400 42,888 70,911 0,291
Einzelnachweise
- Eintrag zu Magnesiumperchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. März 2023. (JavaScript erforderlich)
- L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Magnesiumperchlorat, CD-ROM Ausgabe 12/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4 .
- Long, J.R.: Perchlorate safety: Reconciling inorganic and organic guidelines in Chem. Health Safety 9 (2002) 12–18, doi:10.1016/S1074-9098(02)00294-0.
- Willard, H.H.; Smith, G.F.: The Perchlorates of the Alkali and Alkaline Earth Metals and Ammonium. Their Solubility in Water and Other Solvents in J. Am. Chem. Soc. 45 (1923) 286–297, doi:10.1021/ja01655a004.

