Makrophage
Makrophagen (Abk. ΜΦ; von altgriechisch μακρός makrós, deutsch ‚groß‘ und altgriechisch φαγεῖν phagein, deutsch ‚essen‘, „Riesenfresszelle“)[1] zählen zu den Fresszellen (Phagozyten) und sind Leukozyten (weiße Blutkörperchen), gehören also zu den Zellen des Immunsystems. Sie dienen der Beseitigung von Mikroorganismen durch Phagozytose und stellen stammesgeschichtlich (phylogenetisch) die vermutlich ältesten Teile der angeborenen Immunabwehr dar. So sind makrophagenartige Zellen in der Taufliege Drosophila und sogar in Pflanzen identifiziert worden.[2]
Entwicklung und Vorkommen
Es wird zwischen zwei Arten von Makrophagen aufgrund ihrer entwicklungsbiologischen Herkunft unterschieden. Im Knochenmark entwickeln sich Monozyten und wandern in die Blutgefäße, in denen sie im Blutstrom durch den Körper zirkulieren. Kommen sie währenddessen in Kontakt mit Infektionen, sind sie wie neutrophile Granulozyten in der Lage, verstärkt in das betroffene Gewebe einzuwandern. Dort differenzieren sie unter Einfluss von Cytokinen und Erreger-Substanzen in Makrophagen. Diese Makrophagen sind jedoch nur kurzlebig und müssen ständig durch neue Knochenmarkszellen ersetzt werden. Je nach Stimulierung können sie verschiedene Formen annehmen: Einige verkleinern stark ihr Cytoplasma und werden dann Epitheloidzellen genannt, wegen ihrer Ähnlichkeit zu epithelialen Zellen. Aktivierte Makrophagen können auch fusionieren und mehrkernige Riesenzellen bilden, um größere Fremdkörper durch Phagozytose zu umschließen und zu verdauen. Des Weiteren finden sich Makrophagen in der Muttermilch, in der sie der Sekretion des Enzyms Lysozym und immunstimulatorischer Substanzen dienen.
Unter Normalbedingungen werden keine Monozyten ins Gewebe rekrutiert, um in Makrophagen zu differenzieren. Es gibt aber in allen Organen residente Makrophagen. Um ihre Lokalisierung in verschiedenen Geweben zu beschreiben, wurden ihnen spezielle Bezeichnungen gegeben. So heißen sie im Gehirn Mikroglia, in der Leber Kupffer-Sternzellen, in der Lunge Alveolarmakrophagen, mehrkernig und im Knochen vorkommend Osteoklasten, im Knorpelgewebe Chondroklasten, im Bindegewebe Histiozyten, im Glaskörper des Auges Hyalozyten und in der Plazenta Hofbauerzellen. Die meisten dieser residenten Makrophagen entwickeln sich jedoch nicht im Knochenmark, sondern entstehen in der pränatalen Phase im Dottersack des Embryos, sind langlebig und werden unabhängig von Stammzellen aus dem Knochenmark erhalten.
Die Bezeichnung kann auch nach dem investierten Material erfolgen, dann nennt man sie z. B. Lipophagen (fetthaltig, z. B. „Schaumzellen“ in atherosklerotischen Plaques oder bei Fettgewebsnekrosen), Muziphagen (schleimhaltig, z. B. in Speicheldrüsenzysten) oder Siderophagen (eisen- bzw. hämosiderinhaltig, z. B. nach Blutungen oder als „Herzfehlerzellen“ in der Lunge).
Funktion
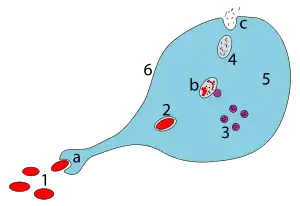
a. Aufnahme durch Phagozytose, ein Phagosom wird gebildet.
b. Die Vereinigung von Phagosom und Lysosom bildet ein Phagolysosom. Der Krankheitserreger wird dann durch Enzyme aufgelöst.
c. Aufgelöstes Material wird ausgeschieden oder assimiliert.
Zeichenerklärung:
1. Krankheitserreger
2. Phagosom
3. Lysosom
4. Reststoffe
5. Zytoplasma
6. Zellmembran
Körperfremde Proteine oder Glycoproteine, wie etwa auf Oberflächen von Viren und Bakterien, werden im Gewebe von Makrophagen erkannt. In einem Phagocytose genannten Prozess werden die Mikroorganismen aufgenommen oder aktiv „umflossen“ und teilweise intrazellulär zerkleinert. Gleichzeitig werden durch auf diese Art „aktivierte“ Makrophagen und neutrophile Granulozyten chemische Lockstoffe (Chemokine) freigesetzt, die weitere Zellen ihrer Art aus dem Blutstrom rekrutieren. Freigesetzte Cytokine sorgen zugleich für eine lokale Entzündung. Die Bestandteile des zuvor aufgenommenen Erregers werden anschließend an die Zelloberfläche des Makrophagen transportiert und mit ihr durch ein MHC-II-Molekül verbunden.
Die Antigenpräsentation erlaubt die Aktivierung von Zellen der erworbenen Immunabwehr (T-Helfer-Zellen). Diese wiederum geben nun an die Makrophagen ein Signal zur Zerstörung der zuvor aufgenommenen Erreger zurück. Im Gegensatz zu den dendritischen Zellen sind aktivierte Makrophagen nur begrenzt fähig, naive (also noch nicht mit einem Antigen in Kontakt gekommene) T-Zellen zu aktivieren. Makrophagen (besonders solche in sekundären lymphatischen Organen) tragen aber dazu bei, dass sich T-Zellen stark vermehren und in „handelnde“ Effektor-T-Zellen und Gedächtnis-T-Zellen differenzieren.[3] Neben dieser Aktivierung der erworbenen Immunabwehr beseitigen Makrophagen auch gealterte, zerstörte sowie apoptotische körpereigene Zellen. Nach einer erfolgreich bekämpften Infektion sind Makrophagen an Heilungsprozessen beteiligt, indem sie die Narbenbildung (Granulationsgewebe) und die Neubildung von Blutgefäßen (Angiogenese) fördern.
Makrophagen können auch direkt an der Funktion eines Organs beteiligt sein. Im Bindegewebe des Hodens beispielsweise sezernieren sie 25-Hydroxy-Cholesterin, eine Substanz, die von benachbarten Leydig-Zellen aufgenommen wird und dort der Synthese von Testosteron dient. Im Falle einer Entzündung des Hodens nehmen die Makrophagen ihre immunologische Aufgabe wahr und stehen nicht mehr für die Unterstützung der Testosteron-Bildung zur Verfügung. Dies führt zur Unfruchtbarkeit.
Beteiligung an Krankheitssymptomen
Im Falle einer Tuberkulose nehmen Makrophagen gemäß ihrer Funktion den Erreger (meist Mycobacterium tuberculosis) auf. Im Gegensatz zu anderen Bakterien vermögen die Tuberkuloseerreger jedoch aufgrund der wachsartigen Beschaffenheit ihrer Zellwand innerhalb der Makrophagen zu überleben. Trotzdem werden aus dem Blut weitere Monozyten rekrutiert, die sich in Epitheloidzellen umwandeln und zusammenlagern. Diese durch ihren katzenzungenartigen Zellkern auffallenden Makrophagen-Abkömmlinge bilden einen Schutzwall, in dessen Zentrum die befallenen Zellen absterben. Das von Epitheloidzellen umschlossene Gebilde von bis zu 1 mm Durchmesser wird als Granulom bezeichnet. Die Epitheloidzellen können außerdem zu mehrkernigen Langhans-Riesenzellen fusionieren, die jedoch nicht mit den Langerhans-Zellen der Epidermis zu verwechseln sind.
Bei Fettstoffwechselstörungen, Fettsucht und Krankheiten wie dem Niemann-Pick-Syndrom oder dem Alport-Syndrom können Makrophagen ein Übermaß an Lipiden aufnehmen und werden dann „Schaumzellen“ genannt. Im Blutstrom spielt diese Form eine Rolle bei der Entstehung der Arteriosklerose.
Bei herzkranken Patienten kann es zu einem Blutstau in den Lungen kommen, was dort eine Akkumulation von Hämosiderin zur Folge hat. Die örtlichen Alveolarmakrophagen nehmen diesen Eisen-Protein-Komplex auf. Diese Zellen und ihre „Fracht“ sind bei entsprechenden Patienten in ausgehusteten Absonderungen der Atemwegsschleimhäute nachweisbar. Sie können so auch als diagnostische Hilfsmittel dienen, was diesen Makrophagen die Bezeichnung „Herzfehlerzellen“ eintrug.
Eine weitere Sonderform der Bindegewebs-Makrophagen sind die „Anitschkow-Zellen“, die bei der Bildung des Rheumatischen Granuloms beteiligt sind. Dieses Gebilde wird auch als Aschoff-Knötchen bezeichnet.
Entdeckungsgeschichte
Auf Rudolf Virchows Vorschlag basierend beschrieb Kranid Slavjanski 1863 erstmals, dass er in Lungenbläschen von Kaninchen, in deren Luftröhre er zuvor eine Zinnober-Lösung träufelte, Zellen fand, „welche den Character weisser Blutkörperchen hatten und stellenweise auch Zinnober enthielten“. Entgegen vorheriger Theorien schloss er aus seinen Experimenten, dass diese Zellen nicht als „metamorphosierte Alveolarepithelien“, also der Lungen-Schleimhaut entstammend, zu sehen seien. Es liege „auf der Hand, sie als weiße Blutzellen anzunehmen, welche aus den Gefäßen herauswandern“.[4] Nach heutigen Kenntnissen beschrieb er somit nicht nur die ersten „verzehrenden“ Alveolar-Makrophagen, sondern auch ihre Fähigkeit, aus dem Blutgefäßsystem in Organe einzuwandern.
Erst Ilja Metschnikow beschrieb 1880 das Prinzip der Phagozytose. Basierend auf seiner Untersuchung phagozytierender Zellen in Seesternen prägte er den Begriff „Makrophage“ und erkannte deren Bedeutung für das Immunsystem.[5] Für diese und weitere Leistungen bei der Beschreibung der zellulären Immunabwehr erhielt Metschnikow zusammen mit Paul Ehrlich im Jahr 1908 den Nobelpreis für Physiologie und Medizin.[6]
In der ersten Hälfte des 20. Jahrhunderts wurde vermehrt die Funktion der „festen“ Gewebe-Makrophagen (Histiozyten) beschrieben. Darauf aufbauend definierten Ludwig Aschoff und andere Wissenschaftler das Prinzip des Retikuloendothelialen Systems (RES), welches in den späten 1960er Jahren unter dem Namen Mononukleär-phagozytierendes System erweitert wurde.[7]
Verglichen mit anderen Zellen erwies sich in den Folgejahren die Untersuchung der Zellbiologie von Makrophagen als schwierig. Erst ab Mitte der 1980er Jahre wurden neue Erkenntnisse über die Bedeutung von Makrophagen gewonnen: So wurde durch Makrophagen nach LPS-Kontakt ein von ihnen produziertes und bis dahin unbekanntes Zytokin entdeckt, der Tumornekrosefaktor.[8] Auch durch die Entdeckung Makrophagen-spezifischer Wachstumsfaktoren wie M-CSF zu dieser Zeit wurden neue Einblicke in die Zell-Differenzierung von Monozyten zu Makrophagen gewonnen.[9]
In den 1990er Jahren wurden vermehrt Oberflächenmarker verwendet, um Subpopulationen von Makrophagen in verschiedenen Geweben zu lokalisieren.[10] Auf diese Weise konnten bisherige Definitionen von Gewebe-spezifischen Makrophagen gefestigt werden.
Immunophänotyp
M1- und M2-Makrophagen
Makrophagen kommen in den meisten Geweben des Körpers vor. Durch Polarisierung entstehen verschiedene Subpopulationen, die spezifische Funktionen erfüllen. Die wichtigsten Subtypen von Makrophagen sind M1- und M2-Makrophagen.[11] M1-Makrophagen entstehen insbesondere nach Kontakt mit Bakterien (LPS) und fördern durch die Ausschüttung von IL-6 und Tumornekrosefaktoren die Entstehung und Aufrechterhaltung einer Entzündung.[12] Sie sind also pro-inflammatorisch. Demgegenüber entstehen M2-Makrophagen insbesondere nach Kontakt mit IL-4 und wirken anti-inflammatorisch.[13] Sie unterdrücken die Entzündungsreaktion und fördern körpereigene Reparaturprozesse. Zu Beginn einer Infektion entstehen deshalb zunächst vor allem M1-Makrophagen, um zur Immunabwehr beizutragen. Später werden dann zunehmend M2-Makrophagen polarisiert, um eine überschießende Immunantwort zu verhindern und nach erfolgreicher Abwehr der Infektion zur Regeneration des Gewebes beizutragen.
Identifikation
Eine Unterscheidung zwischen diesen beiden Subpopulationen ist anhand ihrer Oberflächenmoleküle möglich. M1-Makrophagen besitzen an ihrer Oberfläche folgende Marker: CD80, CD86, CD16/32. Demgegenüber besitzen M2-Makrophagen an ihrer Oberfläche Arginase-1, CD206 (Mannose-Rezeptor).
Klinische Relevanz
Die Unterscheidung zwischen M1- und M2-Makrophagen ist insbesondere in der Krebs-Forschung relevant. Tumoren rekrutieren Makrophagen und polarisieren sie zu M2-Makrophagen. Diese Makrophagen werden dann als Tumor-assoziierte Makrophagen (TAM) bezeichnet.[14] Durch Ausschüttung anti-inflammatorischer Mediatoren wie beispielsweise IL-10 hindern sie das Immunsystem daran den Tumor anzugreifen. Verschiedene Strategien zur therapeutischen Einflussnahme auf diesen Prozess werden erforscht.[15]
Literatur
- Abul K. Abbas, Andrew Lichtman: Molecular and Cellular Immunology. 5. Auflage. Saunders, 2005, ISBN 1-416-02389-5.
- Abul K. Abbas, Andrew Lichtman, Nelson Fausto: Robbins Pathologic Basis of Disease. 7. Auflage. Saunders, 2004, ISBN 0-7216-0187-1.
- Herbert Hof, Rüdiger Dörries: Medizinische Mikrobiologie. 3. Auflage. Thieme, 2005, ISBN 3-13-125313-4.
- T. Gui, A. Shimokado u. a.: Diverse roles of macrophages in atherosclerosis: from inflammatory biology to biomarker discovery. In: Mediators of inflammation. Band 2012, 2012, S. 693083, ISSN 1466-1861. doi:10.1155/2012/693083. PMID 22577254. PMC 3337637 (freier Volltext). (Review).
Einzelnachweise
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. München/ Wien 1965.
- Abul K. Abbas, Andrew Lichtman, Shiv Pillai: Cellular and Molecular Immunology. 6. Auflage. Saunders Elsevier, 2007, S. 30.
- K. M. Murphy u. a.: Janeway Immunologie. 7. Auflage. Spektrum Akademischer Verlag, 2009, ISBN 978-3-8274-2047-3, insbesondere Kapitel 2 und 8.
- Kranid Slavjanski: Experimentelle Beiträge zur Pneumonokoniosis-Lehre. In: Würzburger Medicinische Zeitschrift. Band IV, 1863.
- E. Metchnikoff: Über die intracelluläre Verdauung bei Coelenteraten. In: Zoologischer Anzeiger. 3, 1880, S. 261–263.
- Presentation Speech by Professor the Count K.A.H. Mörner, Rector of the Royal Caroline Institute, on December 10, 1908 Laudatoren-Rede
- R. van Furth: Cells of the mononuclear phagocyte system. Nomenclature in terms of sites and conditions. In: Mononuclear Phagocytes. Functional aspects, Part I; Martinus Nijhoff, The Hague 1980, S. 1–30.
- B. Beutler, J. Mahoney, N. Le Trang, P. Pekala, A. Cerami: Purification of cachectin, a lipoprotein lipase-suppressing hormone secreted by endotoxin-induced RAW 264.7 cells. In: J Exp Med. 161(5), 1. Mai 1985, S. 984–995. PMID 3872925.
- V. Chitu, E. R. Stanley: Colony-stimulating factor-1 in immunity and inflammation. In: Curr Opin Immunol. 18(1), Februar 2006, S. 39–48. PMID 16337366
- S. Gordon, L. Lawson, S. Rabinowitz, P. R. Crocker, L. Morris, V. H. Perry: Antigen markers of macrophage differentiation in murine tissues. In: Curr Top Microbiol Immunol. 181, 1992, S. 1–37. PMID 1424778
- Fernando O. Martinez, Siamon Gordon: The M1 and M2 paradigm of macrophage activation: time for reassessment. In: F1000prime Reports. Band 6, 2014, ISSN 2051-7599, S. 13, doi:10.12703/P6-13, PMID 24669294, PMC 3944738 (freier Volltext).
- Marco Orecchioni, Yanal Ghosheh, Akula Bala Pramod, Klaus Ley: Macrophage Polarization: Different Gene Signatures in M1(LPS+) vs. Classically and M2(LPS-) vs. Alternatively Activated Macrophages. In: Frontiers in Immunology. Band 10, 2019, ISSN 1664-3224, S. 1084, doi:10.3389/fimmu.2019.01084, PMID 31178859, PMC 6543837 (freier Volltext).
- Linnan Zhu, Qingjie Zhao, Tao Yang, Wenjun Ding, Yong Zhao: Cellular metabolism and macrophage functional polarization. In: International Reviews of Immunology. Band 34, Nr. 1, Januar 2015, ISSN 1563-5244, S. 82–100, doi:10.3109/08830185.2014.969421, PMID 25340307.
- Yueyun Pan, Yinda Yu, Xiaojian Wang, Ting Zhang: Tumor-Associated Macrophages in Tumor Immunity. In: Frontiers in Immunology. Band 11, 2020, ISSN 1664-3224, S. 583084, doi:10.3389/fimmu.2020.583084, PMID 33365025, PMC 7751482 (freier Volltext).
- Paulina Pathria, Tiani L. Louis, Judith A. Varner: Targeting Tumor-Associated Macrophages in Cancer. In: Trends in Immunology. Band 40, Nr. 4, April 2019, ISSN 1471-4981, S. 310–327, doi:10.1016/j.it.2019.02.003, PMID 30890304.