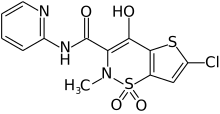
Lornoxicam
Lornoxicam ist ein nichtsteroidales Antirheumatikum (NSAR) aus der Gruppe der Oxicame mit analgetischen, antiphlogistischen und antipyretischen Eigenschaften. Es ist zur oralen, parenteralen und rektalen Gabe verfügbar. Das Arzneimittel ist zur Kurzzeitbehandlung von akuten leichten bis mäßig starken Schmerzen und Beschwerden bei rheumatoider Arthritis und Osteoarthritis vorgesehen, wie Gelenksschmerzen und -entzündungen.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Lornoxicam | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C13H10ClN3O4S2 | ||||||||||||||||||
| Kurzbeschreibung |
Orange-gelbe Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
M01AC05 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 371,82 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert |
4,78[3] | ||||||||||||||||||
| Löslichkeit |
0,046 g·l−1[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Lornoxicam ist ein chloriertes Derivat von Tenoxicam mit einer kürzeren Halbwertszeit. Das 1979 an Hoffmann-La Roche erteilte Patent nennt Rudolf Pfister, Paul Zeller, Dieter Binder und Otto Hromatka als Erfinder.[7] Die Entwicklung erfolgte durch die Nycomed-Tochter HN Pharma, seit 1993 ist es unter dem Handelsnamen „xefo“ in klinischer Verwendung.[8][9] In Österreich kam Lornoxicam 1997 in den Handel, in Deutschland 1999.[10]
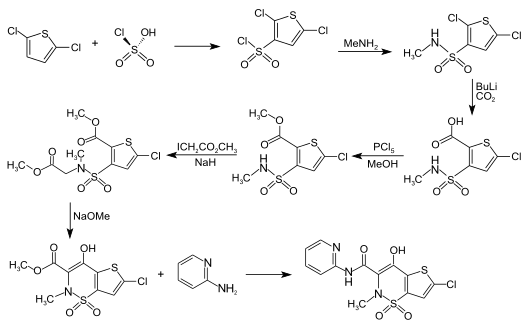
Gewinnung
Die Chlorsulfonierung von 2,5-Dichlorothiophen mit HSO3Cl-SOCl2 ergibt 2,5-Dichlorothiophen-3-sulfonsäurechlorid, welches mit Methylamin in CHCl3 in das Methylamid überführt wird.
Dessen Carboxylierung mit Butyllithium und CO2 in Ether führt zu 5-Chlor-3-(N-methylsulfamoyl)thiophen-2-carbonsäure, die mit PCl5 und Methanol zum Methylester verestert wird.
Dieser kondensiert mit Methyl-Iodacetat in Gegenwart von Natriumhydrid in Dimethylformamid zum 5-Chlor-3-[N-(Methoxycarbonylmethyl)-N-methylsulfamoyl]thiophen-2-carboxylsäuremethylester, welches mit Natriummethanolat in Methanol zum 6-Chlor-4-hydroxy-2-methyl-2H-thieno[2,3-e]-1,2-thiazin-3-carboxylsäuremethylester-1,1-dioxid cyclisiert wird.
Durch Reaktion mit 2-Aminopyridin entsteht schließlich Lornoxicam.[1][7]
Pharmakologie
Pharmakodynamik
Das Medikament bewirkt eine Blockade der Prostaglandin-Synthese durch Hemmung von Cyclooxygenasen; zusätzlich hemmt es die Freisetzung von Sauerstoffradikalen durch aktivierte Leukozyten.
Pharmakokinetik
Oral verabreicht wird die Plasmaspitzenkonzentration nach etwa 2 Stunden erreicht. Lornoxicam wird in der Leber über Cytochrom P450 2C9 mit dem inaktiven Metabolit 5-Hydroxy-Lornoxicam bei einer Absorptionsrate von 90–99 % mit einer für ein Oxicam kurzen Plasmahalbwertszeit von 3–5 Stunden verstoffwechselt. Die Ausscheidung erfolgt zu 2/3 hepatisch und zu 1/3 renal.
Die Proteinbindung beträgt 99 %.
Kontraindikationen
Lornoxicam wird während der Stillzeit oder Schwangerschaft nicht empfohlen und darf in deren letztem Drittel, wie auch bei Thrombozytopenie, schwerer Herzmuskelschwäche, Magengeschwür oder stark eingeschränkter Leber-/Nierenfunktion nicht eingenommen werden.[11][12]
Aufgrund fehlender Daten ist Lornoxicam nicht für Kinder und Jugendliche unter 18 Jahren empfohlen.[6]
Bei Hunden zeigt der Wirkstoff schwere Nebenwirkungen wie Blutstuhl, Fressunlust und Blutarmut infolge Magen- und Zwölffingerdarmgeschwüren. Der Wirkstoff ist nicht für Tiere zugelassen, sondern nur der verwandte Wirkstoff Meloxicam, dennoch kommt es gelegentlich zu Vergiftungen durch Selbstmedikation seitens der Besitzer oder ungewollter Aufnahme durch das Tier.[13]
Nebenwirkungen
Mit Lornoxicam zeigen sich ähnliche Nebenwirkungen wie bei anderen NSAR, häufig milde gastrointestinale Beschwerden, Übelkeit, Diarrhö und Kopfschmerzen. Schwerwiegend aber seltener sind Magenblutungen, Bronchospasmen und sehr selten das Stevens-Johnson-Syndrom.[11] Lornoxicam kann die weibliche Fruchtbarkeit beeinträchtigen.
Bei einer durchgehenden, längeren Einnahme als drei Monaten sollte eine ärztliche Kontrolle der Laborwerte vorgenommen werden.[6] Die körpereigenen Opiatpeptide Dynorphin und Beta-Endorphin werden durch Lornoxicam vermehrt ausgeschüttet.[14][15]
Bei Überschreiten der täglichen Maximaldosis oder der maximalen Einnahmedauer besteht ein geringfügig erhöhtes Risiko eines Schlaganfalls oder Herzinfarkts.[6]
Wechselwirkungen
Dieses Arzneimittel darf nicht mit anderen COX-2 Hemmern wie Acetylsalicylsäure oder Ibuprofen genommen werden. Die möglichen Risiken umfassen Magenblutungen, Durchblutungsstörungen und schwere Schäden an Herz, Leber und Nieren. Bekannte Wechselwirkungen bestehen unter anderem mit Heparin, Phenprocoumon, Kortikosteroiden, Methotrexat, Lithium, Pemetrexed, Ciclosporin, Beta-Blockern, Diuretika, Chinolon-Antibiotika und Sulfonharnstoffen.[6]
Cimetidin kann wie bei Piroxicam die Plasmakonzentration erhöhen, verursacht aber selten relevante Komplikationen.[16]
Handelsnamen
Lornoxicam wird allgemein als Monopräparat vertrieben.[17]
Präparate: Xefo (A, CH), Safem (DK, UK)
Weblinks
Einzelnachweise
- Herstellungsprozess bei drugfuture (englisch).
- Eintrag zu Lornoxicam. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Februar 2016.
- Eintrag zu Lornoxicam in der Human Metabolome Database (HMDB), abgerufen am 26. März 2024.
- Datenblatt Lornoxicam bei Sigma-Aldrich, abgerufen am 11. Februar 2016 (PDF).
- Eintrag zu Lornoxicam in der DrugBank der University of Alberta, abgerufen am 7. Juni 2021.
- Beipacktext von xefo, aufgerufen Februar 2016.
- Patentanmeldung DE2838851: Thiazine derivatives. Angemeldet am 31. August 1978, veröffentlicht am 25. Dezember 1979, Anmelder: Hoffmann-La Roche Inc, Erfinder: Rudolf Pfister, Paul Zeller, Dieter Binder, Otto Hromatka.
- Geschichte von Lornoxicam bei Nycomed (englisch), abgerufen im Februar 2016.
- Nycomed files for Lornoxicam bei pharmaletter.com (englisch), abgerufen am 24. Februar 2016.
- Institut für Gesundheits- und Sozialforschung GmbH: Analog-Wirkstoffe im Arzneimittelmarkt: Therapeutischer Nutzen und Bedeutung für die Ausgaben der Krankenversicherungen (PDF; 1,2 MB), Strukturforschung im Gesundheitswesen Band 30, S. 138f, Berlin 2001. ISBN 3-9808407-1-9. Abgerufen am 26. Februar 2016.
- Haberfeld, H (Hrsg.): Austria-Codex. 2009/2010 Auflage. Österreichischer Apothekerverlag, Wien 2009, ISBN 3-85200-196-X.
- Lornoxicam pharma-kritik bei infomed, 2003.
- V. Karakitsou et al.: Presumptive Lornoxicam intoxication in four dogs. In: Top Comp. Anim. Med. Band 42, 20221, 100502.
- W. Kullich, G. Klein: Die Ausschüttung der körpereigenen Opiatpeptide Dynorphin und β-Endorphin unter dem Einfluß des nicht-steroidalen Antirheumatikums Lornoxicam i.v. In: Aktuelle Rheumatologie. 17, 1992, S. 128, doi:10.1055/s-2008-1047362.
- Godara Sushila, Srivastava R, Godara Rajesh, Bhutani Garima: Lornoxicam: a review of its therapeutic potential in different clinical studies. In: Journal of Drug Delivery & Therapeutics; 2013, 3(2), 145-148.
- Klopp, T (Hrsg.): Arzneimittel-Interaktionen. 2010/2011 Auflage. Arbeitsgemeinschaft für Pharmazeutische Information, 2010, ISBN 978-3-85200-207-1.
- Drugs.com International: Lornoxicam (englisch).
