Linalylacetat
Linalylacetat ist ein Monoterpenoid-Ester, der sich von der Essigsäure und von Linalool ableitet. Es ist eine farblose Flüssigkeit mit frischem, süßen Geruch. Es ist eine wichtige Aromakomponente in verschiedenen Pflanzen und ätherischen Ölen und wird auch industriell als Duft- und Aromastoff verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
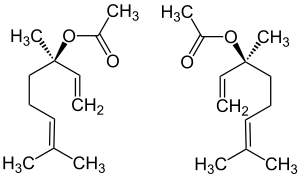 | ||||||||||||||||
| (R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Linalylacetat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C12H20O2 | |||||||||||||||
| Kurzbeschreibung |
farblose, angenehm nach Bergamotte riechende Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 196,29 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,9 g·cm−3 [3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
220 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Isomere
Die Substanz hat ein stereogenes Zentrum am Kohlenstoffatom der Position 3 und tritt somit in Form zweier Enantiomere auf.
| Isomere von Linalylacetat | ||
| Name | (R)-(–)-Linalylacetat | (S)-(+)-Linalylacetat |
| Strukturformel |  | |
| CAS-Nummer | 16509-46-9 | 51685-40-6 |
| 115-95-7 (Racemat) | ||
| PubChem | 442474 | 6999980 |
| 8294 (unspez.) | ||
| ECHA-Infocard | 100.003.743 (unspez.) | |
| FL-Nummer | 09.013 (Racemat) | |
Vorkommen
Linalylacetat kommt in vielen ätherischen Ölen vor. (R)-(–)-Linalylacetat findet sich als Hauptkomponente im Lavendelöl (30 – 60 %) und im Lavandinöl (25 – 50 %).[5][6][7] Im Muskatellersalbeiöl (bis über 75 %) ist es ebenfalls die Hauptkomponente, während es Salvia dominica in nicht ganz so hoher Menge vorkommt.[5][8] Im Bergamottöl (30 – 45 %) ist es die Hauptkomponente neben Limonen.[5][9][10] Außerdem kommt es auch in den ätherischen Ölen anderer Zitrusfrüchte vor, beispielsweise von Daidai[11], Bitterorange[12], sowie Zitrone und Limette.[13] Weitere Öle, die Linalylacetat enthalten, sind die von Möchspfeffer[14], von Magnolia officinalis[15] und von Zitronenminze (einer Unterart der Wasserminze).[8] In geringer Menge kommt es in Myrtenöl (aus Myrtus communis)[8][16] und dem Öl von Kardamom[10] vor. Linalylacetat ist (neben anderen Terpinoiden) in großer Menge in den Blättern des Maulbeerbaums enthalten und wirkt anziehend auf die Larven des Seidenspinners (Bombyx mori), die sich von den Blättern ernähren.[17]
 Lavendel
Lavendel Muskatellersalbei
Muskatellersalbei Bergamotte
Bergamotte Seidenspinner auf Maulbeerpflanze
Seidenspinner auf Maulbeerpflanze
Biosynthese
Die Biosynthese in der Zitronenminze wurde untersucht. Durch enzymatische Reaktion wird Geranyldiphosphat in Linalool umgewandelt und anschließend acetyliert.[18] Einige Pflanzen, wie die Zitronenminze und Lippia alba verfügen über spezifische Esterasen, die Linalylacetat wieder zu Linalool abbauen können. Solche Enzyme sind aber deutlich weniger verbreitet als Esterasen, die Geranylacetat hydrolysieren.[19]
Gewinnung und Darstellung
Linalylacetat lässt sich aus den oben erwähnten ätherischen Ölen gewinnen. Synthetisch lässt sich Linalylacetat durch Veresterung von Linalool gewinnen, wobei auf milde Reaktionsbedingungen geachtet werden muss, da Linalool als ungesättigter tertiärer Alkohol zur Dehydratisierung und Cyclisierung neigt. Geeignete Synthesewege ausgehend von Linalool wären beispielsweise die Umsetzung mit Ethenon[20], mit kochendem Essigsäureanhydrid unter Abdestillation der entstehenden Essigsäure[21] oder eine Umesterung mittels Essigsäure-tert-butylester in der Gegenwart von Natriummethanolat.[22]
Aus Dehydrolinalool lässt es sich durch Veresterung mit Essigsäureanhydrid und anschließender partieller Hydrierung gewinnen.[23] Ebenfalls eingesetzt wird die Umsetzung von β-Pinen mit Essigsäure und Natriumacetat in der Gegenwart von Kupfer(I)-chlorid, wobei Linalylacetat mit einer Ausbeute von 75 – 80 % entsteht.[24]
Eigenschaften
Linalylacetat neigt zur Autoxidation und bildet an Luft Hydroperoxide.[25][26] Linalylacetat wirkt im Tierversuch an Ratten und Mäusen entzündungshemmend.[27][28]
Verwendung
Linalylacetat wird extensiv in der Parfümerie verwendet. Auf Grund seiner guten Stabilität im basischen Milieu wird es auch oft in Seifen oder Waschmitteln eingesetzt.[5] Die jährliche weltweite Verwendungsmenge als Duftstoff beträgt über 1000 Tonnen.[29] Linalylacetat wird außerdem als Aromastoff verwendet und ist in der EU unter der FL-Nummer 09.013 für Lebensmittel allgemein zugelassen.[30]
Sicherheitshinweise
Linalylacetat zählt zu den chemischen Substanzen, die in großen Mengen hergestellt werden („High Production Volume Chemical“, HPVC) und für die von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) eine Datensammlung zu möglichen Gefahren („Screening Information Dataset“, SIDS) angefertigt wurde.[31] Die akute Toxizität der Verbindung ist gering, alle oralen LD50-Werte, die in verschiedenen Studien an Ratten und Mäusen ermittelt wurden, betrugen über 10 g/kg Körpergewicht. Die Verbindung kann Augenreizungen verursachen, verursacht aber wenig bis keine Hautreizungen.[29] Reines Linalylacetat verursacht auch keine allergischen Reaktionen, allerdings wirken die Produkte der Autoxidation von Linalylacetat als Kontaktallergene.[25][26][29] Die Dämpfe von Linalylacetat können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 94 °C, Zündtemperatur 225 °C) bilden.[3]
Einzelnachweise
- Eintrag zu LINALYL ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Eintrag zu Linalylacetat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. November 2014.
- Eintrag zu Linalylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- Richard J. Lewis, Sr.: Hawley's Condensed Chemical Dictionary. 15. Auflage. Wiley-Interscience, 2007, ISBN 978-0-471-76865-4 (englisch).
- Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe und Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, 2003, ISBN 3-527-30673-0, doi:10.1002/14356007.a11_141.
- K. H.C. Baser, Temel Özek, Angel Konakchiev: Enantiomeric Distribution of Linalool, Linalyl Acetate and Camphor in Bulgarian Lavender Oil. In: Journal of Essential Oil Research. Band 17, Nr. 2, März 2005, S. 135–136, doi:10.1080/10412905.2005.9698855.
- Uzi Ravid, Eli Putievsky, Michal Bassat, Raphael Ikan, Vera Weinstein: Isolation of optically pure (−)-linalyl acetate from clary sage,Salvia dominica L., Lavender and Lavandin. In: Flavour and Fragrance Journal. Band 1, Nr. 3, Juni 1986, S. 121–124, doi:10.1002/ffj.2730010306.
- Uzi Ravid, Eli Putievsky, Irena Katzir: Chiral gc analysis of enantiomerically pure (r)(—)-linalyl acetate in some lamiaceae, myrtle and petitgrain essential oils. In: Flavour and Fragrance Journal. Band 9, Nr. 5, September 1994, S. 275–276, doi:10.1002/ffj.2730090515.
- F. Gülay Kirbaslar, S. Ismail Kirbaslar, Umur Dramur: The Compositions of Turkish Bergamot Oils Produced by Cold-Pressing and Steam Distillation. In: Journal of Essential Oil Research. Band 13, Nr. 6, November 2001, S. 411–415, doi:10.1080/10412905.2001.9699710.
- E. Jakab, M. Blazsó, E. Barta-Rajnai, B. Babinszki, Z. Sebestyén, Zs. Czégény, J. Nicol, P. Clayton, K. McAdam, C. Liu: Thermo-oxidative decomposition of lime, bergamot and cardamom essential oils. In: Journal of Analytical and Applied Pyrolysis. Band 134, September 2018, S. 552–561, doi:10.1016/j.jaap.2018.08.003.
- S. M. Njoroge, H. Ukeda, H. Kusunose, M. Sawamura: Volatile components of the essential oils from Kabosu, Daidai, and Yuko, Japanese sourcitrus fruits. In: Flavour and Fragrance Journal. Band 9, Nr. 6, November 1994, S. 289–297, doi:10.1002/ffj.2730090603.
- F. Gülay Kirbaslar, S. Ismail Kirbaslar: Composition of Cold-Pressed Bitter Orange Peel Oil from Turkey. In: Journal of Essential Oil Research. Band 15, Nr. 1, Januar 2003, S. 6–9, doi:10.1080/10412905.2003.9712247.
- Marie-Laure Lota, Dominique de Rocca Serra, Félix Tomi, Camille Jacquemond, Joseph Casanova: Volatile Components of Peel and Leaf Oils of Lemon and Lime Species. In: Journal of Agricultural and Food Chemistry. Band 50, Nr. 4, 1. Februar 2002, S. 796–805, doi:10.1021/jf010924l.
- Felice Senatore, Giovanna Della Porta, Ernesto Reverchon: Constituents ofVitex agnus-castus L. Essential Oil. In: Flavour and Fragrance Journal. Band 11, Nr. 3, Mai 1996, S. 179–182, doi:10.1002/(SICI)1099-1026(199605)11:3<179::AID-FFJ566>3.0.CO;2-6.
- Q. Pu, L. Pannell, Ji Xiao-duo: The Essential Oil of Magnolia officinalis. In: Planta Medica. Band 56, Nr. 01, Februar 1990, S. 129–130, doi:10.1055/s-2006-960908.
- Mahmood Dejam, Yaser Farahmand: Essential Oil Content and Composition of Myrtle ( Myrtus communis L.) Leaves from South of Iran. In: Journal of Essential Oil Bearing Plants. Band 20, Nr. 3, 4. Mai 2017, S. 869–872, doi:10.1080/0972060X.2014.981599.
- Yasuji Hamamura, Keizo Hayashiya, Ken-Ichi Naito: Food Selection by Silkworm Larvæ, Bombyx Mori : β-Sitosterol as one of the Biting Factors. In: Nature. Band 190, Nr. 4779, Juni 1961, S. 880–881, doi:10.1038/190880a0.
- Alon Zaks, Rachel Davidovich-Rikanati, Einat Bar, Moshe Inbar, Efraim Lewinsohn: Biosynthesis of linalyl acetate and other terpenes in lemon mint (Mentha aquatica var. citrata, Lamiaceae) glandular trichomes. In: Israel Journal of Plant Sciences. Band 56, Nr. 3, 1. Dezember 2008, S. 233–244, doi:10.1560/IJPS.56.3.233.
- Neelam S. Sangwan, Pankaj K. Sharma, Rajender S. Sangwan: Geranyl acetate esterase is commonly present but linalyl acetate esterase occurrence is highly limited in plants. In: Flavour and Fragrance Journal. Band 22, Nr. 3, Mai 2007, S. 173–177, doi:10.1002/ffj.1775.
- Patent GB878680: Production of linalyl acetate. Veröffentlicht am 4. Oktober 1961, Anmelder: Distillers Company, Erfinder: Peter Nayler.
- Patent DE2025727: Process for esterification of tertiary terpenic alcohols. Veröffentlicht am 3. Dezember 1970, Anmelder: Rhône-Poulenc Ind., SA, Erfinder: P. S. Gradeff, B. Finer.
- Patent DE1768980: Verfahren zur Herstellung von Carbonsaeureestern olefinisch ungesaettigter tertiaerer Alkohole. Veröffentlicht am 12. August 1971, Anmelder: BASF, Erfinder: H. Pasedach.
- Patent GB774621: Novel acetylenic esters and the conversion thereof into further esters. Veröffentlicht am 15. Mai 1957, Anmelder: Hoffmann-La Roche, Erfinder: J. A. Birbiglia, G. O. Chase, J. Galender.
- Patent US3076839: Process for producing allylic esters. Veröffentlicht am 5. Februar 1963, Anmelder: Glidden Co, Erfinder: R. L. Webb.
- Lina Hagvall, Victoria Berglund, Johanna Bråred Christensson: Air‐oxidized linalyl acetate – an emerging fragrance allergen? In: Contact Dermatitis. Band 72, Nr. 4, April 2015, S. 216–223, doi:10.1111/cod.12350.
- Maria Sköld, Lina Hagvall, Ann-Therese Karlberg: Autoxidation of linalyl acetate, the main component of lavender oil, creates potent contact allergens. In: Contact Dermatitis. Band 58, Nr. 1, 27. November 2007, S. 9–14, doi:10.1111/j.1600-0536.2007.01262.x.
- A.T. Peana, P.S. D'Aquila, F. Panin, G. Serra, P. Pippia, M.D.L. Moretti: Anti-inflammatory activity of linalool and linalyl acetate constituents of essential oils. In: Phytomedicine. Band 9, Nr. 8, Januar 2002, S. 721–726, doi:10.1078/094471102321621322.
- Vineet Kumar Rai, Priyam Sinha, Kuldeep Singh Yadav, Aparna Shukla, Archana Saxena, Dnyaneshwar Umrao Bawankule, Sudeep Tandon, Feroz Khan, Chandan Singh Chanotiya, Narayan Prasad Yadav: Anti-psoriatic effect of Lavandula angustifolia essential oil and its major components linalool and linalyl acetate. In: Journal of Ethnopharmacology. Band 261, Oktober 2020, S. 113127, doi:10.1016/j.jep.2020.113127.
- C.S Letizia, J Cocchiara, J Lalko, A.M Api: Fragrance material review on linalyl acetate. In: Food and Chemical Toxicology. Band 41, Nr. 7, Juli 2003, S. 965–976, doi:10.1016/S0278-6915(03)00014-0.
- Food and Feed Information Portal Database | FIP. Abgerufen am 20. Oktober 2023.
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Linalylacetate, abgerufen am 3. Oktober 2014.
