Kupfer(II)-fluorid
Kupfer(II)-fluorid ist eine chemische Verbindung aus der Gruppe der Fluoride.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
-fluoride-xtal-packing-3D-bs-17.png.webp) | ||||||||||
| Allgemeines | ||||||||||
| Name | Kupfer(II)-fluorid | |||||||||
| Andere Namen |
Kupferdifluorid | |||||||||
| Summenformel | CuF2 | |||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 101,54 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1676 °C[3] | |||||||||
| Löslichkeit |
wenig löslich in kaltem Wasser (47 g·l−1 bei 20 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
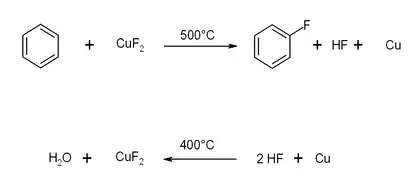
Kupfer(II)-fluorid kann durch Reaktion von Kupfer(II)-chlorid mit Fluor oder Kupfer(II)-oxid mit Fluorwasserstoff bei 400 °C gewonnen werden.[1][4]
Eigenschaften
Kupfer(II)-fluorid ist ein weißes, kristallines, luftempfindliches Pulver, das wenig löslich in kaltem Wasser ist. Von heißem Wasser wird es hydrolytisch gespalten. Ist es nicht völlig wasserfrei, färbt es sich beim Erhitzen schwach grau.[1] In Gegenwart von Wasser bildet sich ein hellblaues Dihydrat, welches bei Temperaturen über 130 °C[3] sein Kristallwasser wieder abgibt. Mit Fluoridionen bilden sich die komplexe Anionen CuF3−, CuF42− und CuF64−. Als Feststoff liegt Kupfer(II)-fluorid in verzerrter Rutilstruktur vor. In der Schmelze zersetzt es sich langsam unter Abgabe von Fluor zu Kupfer(I)-fluorid und Kupfer.[4]
Verwendung
Kupfer(II)-fluorid kann zur Fluorierung von aromatischen Kohlenwasserstoffen verwendet werden. Dabei sind jedoch relativ hohe Temperaturen notwendig, was diese Reaktion für viele Produkte unmöglich macht.[5]
Analog kann Kupfer(II)-fluorid bei hohen Temperaturen auch als Fluorierungsmittel für anorganische Stoffe, beispielsweise für Tantal, verwendet werden.[4]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 246.
- Datenblatt Copper(II) fluoride, 98 % bei Sigma-Aldrich, abgerufen am 30. November 2011 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. CRC Press, 2009, ISBN 978-1-4200-9084-0.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- M. A. Subramanian, L. E. Manzer: A "Greener" Synthetic Route for Fluoroaromatics via Copper (II) Fluoride. In: Science. 297. Jahrgang, Nr. 5587, 2002, S. 1665, doi:10.1126/science.1076397, PMID 12215637.