Kornblum-Regel
Die Kornblum-Regel ist ein Konzept der Organischen Chemie, das die Abschätzung des bevorzugt gebildeten Produkts einer nukleophilen Substitution mit ambidenten Nukleophilen erlaubt. Die Regel basiert auf dem Konzept harter und weicher Säuren und Basen (HSAB-Konzept). Bei einer SN1-Reaktion greift bevorzugt die härtere (elektronegativere) Position des Nukleophils an, bei einer SN2-Reaktion dagegen der weichere (nukleophilere) Teil.
Beispiel
Die Kornblum-Regel gilt nicht für alle Reaktionen mit ambidenten Nukleophilen, sie ist nur eine Abschätzung, welches Haupt- und welches Nebenprodukt entsteht. Im folgenden Beispiel, mit dem Cyanid-Anion |N≡C|− als Nukleophil ist sie jedoch erfüllt:
| Stickstoff (N) | 3,04 |
| Kohlenstoff (C) | 2,55 |
Das heißt, dass bei einer SN1-artigen Reaktion der Stickstoff angreift und bei einer SN2-artigen der Kohlenstoff.
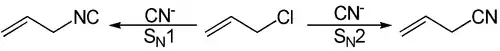
Damit entsteht bei der folgenden SN1-Reaktion: CH2=CH-CH2-Cl + KCN bevorzugt die Isonitril-Verbindung CH2=CH-CH2-NC, während die ebenfalls denkbare Nitril-Verbindung CH2=CH-CH2-CN nur als Nebenprodukt entsteht.
Hierbei ist zu beachten, dass die Reaktionsrichtung von den Reaktionsbedingungen abhängt. Polar-aprotische Lösemittel begünstigen SN2-Reaktionen, weil hier die kaum solvatisierten Anionen ihre Nukleophilie voll ausspielen können, während in protischen Lösemitteln die solvatisierten Anionen in ihrer Reaktivität behindert sind und so SN1-Reaktionen bevorzugt ablaufen.
Auch Kationen können die Reaktionsrichtung beeinflussen: ersetzt man im obigen Beispiel KCN durch AgCN, so erhält man eine höhere Ausbeute an Isonitril, da das Silberion als weiche Lewissäure bevorzugt an das (weichere) C-Atom des Cyanidions koordiniert und dieses dadurch am Angriff hindert. Dadurch wird die Reaktionsrichtung nach „SN1-artig“ verschoben. Bei der Reaktion von Alkylhalogeniden mit Silbernitrit erhält man – verglichen mit Alkalicyaniden – mehr Alkylnitrite, da hier das Silberion an das – in diesem Fall weichere – N-Atom koordiniert. Weiterhin unterstützen Ag+-Ionen die Ablösung von Chlorid, Bromid und Iodid durch Koordination an das Halogen, wodurch die positive Polarisation des benachbarten C-Atoms verstärkt wird; ggf. dissoziiert der Komplex zum Silberhalogenid und dem Carbeniumion, wobei dann auch Umlagerungen zu beobachten sind.
Einzelnachweise
- Autorenkollektiv: Organikum. 21. Auflage, S. 222–223, Wiley-VCH, 2001, ISBN 3-527-29985-8.