Kohlenwasserstoffe
Die Kohlenwasserstoffe sind eine Stoffgruppe chemischer Verbindungen, die nur aus Kohlenstoff und Wasserstoff bestehen.[1] Diese Stoffgruppe ist vielfältig, da Kohlenwasserstoffe Kohlenstoffketten, -ringe oder Kombinationen daraus enthalten können. Es gibt mehrere Untergruppen wie Alkane, Alkene, Alkine und Aromaten (Arene). Die Kohlenwasserstoffe haben vor allem durch ihre Verwendung als fossile Brennstoffe und in der organischen Synthese eine große technische Bedeutung erlangt.
| Kohlenwasserstoffe |
 Methan |
 Ethan |
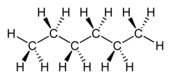 n-Hexan |
 Ethen |
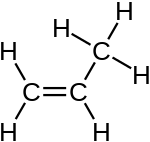 Propen |
Ethin |
 Benzol |

Vorkommen
Kohlenwasserstoffe sind in der Natur insbesondere in Erdöl und Erdgas in sehr großer Menge enthalten,[2] weshalb diese beiden Bodenschätze auch unter dem Überbegriff fossile Kohlenwasserstoffe zusammengefasst werden. Sie sind zudem verbreitet in vielen Pflanzen z. B. als Terpene, Carotinoide und Kautschuk, und so kommen sie fossil auch in Kohle vor. Einfache Kohlenwasserstoffe, insbesondere Methan, sind Stoffwechselprodukte einiger Mikroorganismen.[3] Im Weltall sind Kohlenwasserstoffe meist in Form von Methan und Ethan, auf Kometen, Planeten und Monden sowie in interstellarer Materie nachgewiesen.[4][5]
Einige wenige (wie zum Beispiel Idrialin und Kratochvílit) treten in der Natur auch als Mineral auf.[6]
Systematik
Kohlenwasserstoffe lassen sich unterteilen in die aromatischen und die aliphatischen Kohlenwasserstoffe, bei denen wieder ungesättigte und gesättigte Verbindungen unterschieden werden.[2]
Gesättigte Kohlenwasserstoffe
Bei gesättigten Kohlenwasserstoffen handelt es sich um chemische Verbindungen, die ausschließlich C-C-Einfachbindungen enthalten. Alle anderen möglichen Bindungen sind bereits mit Wasserstoffatomen besetzt und es lässt sich kein Wasserstoff anlagern, eine weitere Hydrierung ist nicht möglich. Sie werden in unverzweigte, verzweigte und ringförmige Verbindungen unterteilt.[2] Gesättigte Kohlenwasserstoffe reagieren träger als die ungesättigten Kohlenwasserstoffe mit gleicher Anzahl von Kohlenstoffatomen. Die einfachsten Alkane sind Methan (CH4), Ethan (C2H6), und Propan (C3H8).
Bei mehr als drei Kohlenstoffatomen, also ab den Butanen (C4 H10), kann das Molekül unverzweigt oder verzweigt sein. Es handelt sich dann um Konstitutionsisomere. Verzweigte Moleküle entstehen, wenn mindestens ein Kohlenstoffatom mit drei oder mehr anderen Kohlenstoffatomen verbunden ist. Bei kettenförmigen Verbindungen hat jedes Atom maximal zwei Bindungen mit anderen Kohlenstoffatomen. Kohlenwasserstoffe mit gleicher Summenformel können somit verschiedene Strukturformeln (Verknüpfungen der C-Atome) aufweisen. Unverzweigte und verzweigte Kohlenwasserstoffe werden systematisch als Alkane bezeichnet. Allgemein lautet die Summenformel für die homologe Reihe der kettenförmigen und verzweigten Alkane CnH2n+2. Unverzweigte und verzweigte Alkane mit derselben Anzahl von Kohlenstoff- und Wasserstoffatomen haben leicht unterschiedliche physikalische und chemische Eigenschaften, ebenso ist ihre biologische Abbaubarkeit unterschiedlich.
- Das kürzeste Molekül das verzweigt und unverzweigt sein kann, ist das Butan. Zur Unterscheidung zwischen verzweigten und unverzweigten Kohlenwasserstoffen wird bei der unverzweigten Version ein „n-“ vorangestellt, also n-Butan. Der einfachste verzweigte Kohlenwasserstoff ist Isobutan (oder nach der Nomenklatur 2-Methylpropan) aus vier Kohlenstoffatomen. Man kann es als ein abgewandeltes Propan betrachten: Das zweite Kohlenstoffatom eines Propanmoleküls trägt eine Methylgruppe statt einem Wasserstoffatom, daraus leitet sich der Name 2-Methylpropan ab. Butan und Isobutan haben dieselbe Anzahl von Kohlenstoff- und Wasserstoffatomen.
- Der einfachste verzweigte Kohlenwasserstoff, bei dem mindestens ein Atom mit vier weiteren Kohlenstoffen verbunden ist, also mit einem quartären Kohlenstoffatom, ist Neopentan (2,2-Dimethylpropan). Neopentan ist neben n-Pentan und Isopentan eines der drei Strukturisomere der Pentane mit der Summenformel C5H12.
- Ringförmige Alkane werden als Cycloalkane bezeichnet, beispielsweise Cyclohexan. Ihre allgemeine Summenformel für die homologe Reihe lautet CnH2n.[2]
Ungesättigte Kohlenwasserstoffe
Ungesättigte Kohlenwasserstoffe lassen sich hydrieren. Sie sind allgemein reaktiver als gesättigte Kohlenwasserstoffe mit der gleichen Anzahl Kohlenstoffatome. Sie lassen sich nach der Art der Bindungen in Alkene und Alkine einteilen.[7] Auch ungesättigte Kohlenwasserstoffe können verzweigt oder unverzweigt sein.
- Bei den Alkenen handelt es sich um Verbindungen, die C=C-Doppelbindungen enthalten. Der einfachste Vertreter dieser Stoffgruppe ist das Ethen, auch Ethylen genannt (C2H4). Die einfachsten n-Alkene mit nur einer Doppelbindung haben allgemein die Summenformel CnH2n.[7] Als Polyene werden Verbindungen mit mindestens zwei C=C-Doppelbindungen, wie zum Beispiel 1,3-Butadien, bezeichnet. Cycloalkene sind cyclische Kohlenwasserstoffe, wie zum Beispiel Cyclopentadien. Hier liegen C=C-Doppelbindungen innerhalb eines Kohlenstoffringes vor. Die klassische cis-trans-Isomerie tritt mitunter an C=C-Doppelbindungen auf. Einfache verzweigte Kohlenwasserstoffe können, wie das Beispiel 3-Methylhexan zeigt, chiral sein. Das Kohlenstoffatom in Position Nummer 3 wird hier zum Stereozentrum, die Verbindung ist asymmetrisch und man unterscheidet zwischen den (R)- und (S)-Enantiomeren.
- Alkine sind Kohlenwasserstoffe, die eine oder mehrere C≡C-Dreifachbindungen enthalten. Der bekannteste Vertreter ist das Ethin (Acetylen) mit der Summenformel C2H2. Dementsprechend haben Alkine mit einer Dreifachbindung allgemein die Summenformel für die homologe Reihe CnH2n-2.[7]
Aromatische Kohlenwasserstoffe
Die dritte wichtige Gruppe sind die aromatischen Kohlenwasserstoffe. Dabei handelt es sich um Kohlenwasserstoffe, die Aromatizität aufweisen und meist C6-Ringe besitzen (Arene). Der bekannteste Vertreter ist das Benzol (C6H6). Eine Untergruppe der Aromaten sind die polyzyklischen aromatischen Kohlenwasserstoffe. Bei ihnen handelt es sich um Verbindungen, die aus mehreren aneinander hängenden Benzolringen bestehen. Ein bekannter Vertreter ist das Naphthalin (C10H8).[7]
Kohlenwasserstoffe, die vom Aufbau her Platonischen Körpern entsprechen, bezeichnet man als Platonische Kohlenwasserstoffe. Hierzu gehören Tetrahedran, Cuban und Dodecahedran.[8]
Gewinnung und Darstellung
Es sind eine Reihe von Syntheseverfahren für Kohlenwasserstoffe bekannt. Für Alkane sind die Wurtz-Synthese und die Kolbe-Synthese allgemeine Darstellungsverfahren, um gezielt Kohlenwasserstoffe bestimmter Kettenlänge zu erhalten.[2] Bedeutend ist auch die Fischer-Tropsch-Synthese zur Herstellung von Gemischen von Alkanen und Alkenen. Bei den aromatischen Kohlenwasserstoffen sind die Dehydrocyclisierung und Crackaromatisierung bekannte Syntheseverfahren.[9]
Eigenschaften
In Wasser weisen viele unpolare Kohlenwasserstoffe eine sehr geringe Löslichkeit auf;[10][11] in den meisten organischen Lösungsmitteln jedoch gut löslich. Das heißt, Kohlenwasserstoffe sind hydrophob, also auch lipophil.
Gasförmige Kohlenwasserstoffe brennen sehr schnell und mit heißer Flamme; die dabei frei werdende Energie ist groß. Flüssige Kohlenwasserstoffe mit niedrigem Siedepunkt verdampfen leicht; infolge ihres auch niedrigen Flammpunktes sind Brände leicht zu entfachen. Bei der optimalen (vollständigen) Verbrennung von Kohlenwasserstoffen entsteht Wasser und Kohlenstoffdioxid, bei unzureichender (unvollständiger) Verbrennung können auch Kohlenstoffmonoxid oder Kohlenstoff (Ruß) entstehen.[12] Die Reaktivität der Alkane ist abhängig von ihrer Kettenlänge. Langkettige Alkane sind relativ inert (wenig reaktiv). Verbrennt Kohlenwasserstoff mit rußender Flamme, kann dies auch ein Anzeichen für einen höheren Kohlenstoffanteil in der Verbindung (größere Kettenlänge) sein.
Alkane gehen aber – neben Redoxreaktionen bei ihrer Verbrennung – Substitutionsreaktionen ein, wobei Wasserstoffatome gegen andere Atome und Atomgruppen, aber hauptsächlich Halogenen ausgetauscht werden können. Alkene und Alkine hingegen sind recht reaktionsfreudig und reagieren mit vielen Verbindungen unter Anlagerung an die C-C-Mehrfachbindung (Additionsreaktion).[13]
Die vergleichsweise hohe Neigung der Kohlenstoffatome zur Ausbildung von Ketten C-C-C-… (Verkettung oder Katenisierung, englisch catenation, von lateinisch catena ‚Kette‘) ist für die Vielfalt der Kohlenwasserstoffe entscheidend und beruht auf der höheren Bindungsenergie der kovalenten C–C Bindungen (356 kJ/mol) im Vergleich zu höheren Homologen der 14. Gruppe (z. B. Si–Si (226 kJ/mol), Ge–Ge (186 kJ/mol)). Weiterhin ist die C–H-Bindung ebenfalls thermodynamisch stabiler als die Si–H-, Ge–H- oder Sn–H-Bindung. So kann erklärt werden, warum es eine höhere Vielfalt an Kohlen-, als an Silicium- oder Germaniumwasserstoffen gibt.[14]
Verwendung

_Tank_wagon_33_80_7920_362-0_with_hydrocarbon_gas_at_Bahnhof_Enns.jpg.webp)
Alkane werden häufig als fossiler Energieträger in Gemischen wie Biogas, Flüssiggas, Benzin, Dieselkraftstoff, Heizöl, Kerosin, Petroleum verwendet.[15] Die bedeutendsten Alkane sind die niedermolekularen Alkane Methan, Ethan und Propan. Alkane wie Butan, Isopentan, verschiedene Hexane und das Cycloalkan Cyclohexan sind Bestandteile in Motorenbenzin.[16]
Die Kohlenwasserstoffe dienen als Ausgangsstoff für eine Vielzahl von industriell bedeutenden chemischen Synthesevorgängen. Von technischer Bedeutung sind Alkene wie Ethen und Cyclohexen, Alkine wie Ethin und Polyene wie 1,3-Butadien, Isopren und Cyclopentadien. Viele Arene besitzen technische Bedeutung, darunter Benzol, Toluol, Xylol und Styrol.[17]
Wichtig sind die Polymerisationsprodukte der Kohlenwasserstoffe wie zum Beispiel Polystyrol, Polyethylen, Polypropylen, Polyethin, viele Copolymere sowie die halogenierten Kohlenwasserstoffpolymere wie Polyvinylchlorid und Polytetrafluorethylen.[17] Darüber hinaus dienen Kohlenwasserstoffe als lipophile Lösemittel.
Umweltbelastung
Kohlenwasserstoffe machen – nach Definition der Weltgesundheitsorganisation WHO – den Hauptteil der flüchtigen organischen Verbindungen (abgekürzt auch VOC) aus; diese gelten bei Emission als umweltschädigend. Zwecks Emissionsreduktion wird z. B. in der Schweiz auf diese Emissionen eine Lenkungsabgabe (VOC-Abgabe) erhoben.[18] Außerdem hat Methangas einen fördernden Einfluss auf den Treibhauseffekt.[19]
Siehe auch
Literatur
- Handbuch der Experimentellen Chemie Sekundarbereich II, Band 9, Kohlenwasserstoff, Aulis Verlag Deubner & Co. KG.
- Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
- J. C. Jones: Hydrocarbons. Physical Properties and their Relevance to Utilisation. J. C. Jones & Ventus Publishing ApS, 2010. ISBN 978-87-7681-513-4.
- Hartung, Birgitta (1984). Potentielle Kohlenwasserstoff-Muttergesteine in der Tiefsee. Geowissenschaften in unserer Zeit; 2, 6; 208–211; doi:10.2312/geowissenschaften.1984.2.208.
Weblinks
Einzelnachweise
- Eintrag zu hydrocarbons. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02889 – Version: 2.3.2.
- Hans P. Latscha, Helmut A. Klein: Organische Chemie. Springer Berlin Heidelberg, 2013, ISBN 978-3-662-09141-8, S. 33 (eingeschränkte Vorschau in der Google-Buchsuche).
- Norbert Berkowitz: Fossil Hydrocarbons. Elsevier Science, 1997, ISBN 978-0-08-053188-5, S. 7 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michael Köhler: Vom Urknall zum Cyberspace. Wiley, 2011, ISBN 3-527-32739-8, S. 68 (eingeschränkte Vorschau in der Google-Buchsuche).
- International Astronomical Union. Symposium: Organic Matter in Space (IAU S251). Cambridge University Press, 2008, ISBN 978-0-521-88982-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- Shaunna M. Morrison, Simone E. Runyon, Robert M. Hazen: The Paleomineralogy of the Hadean Eon Revisited. In: Life. Band 8, Nr. 4, 2018, ISSN 2075-1729, S. 64, doi:10.3390/life8040064, PMID 30562935, PMC 6315770 (freier Volltext).
- Guido Kickelbick: Chemie für Ingenieure. Pearson Deutschland, 2008, ISBN 978-3-8273-7267-3, S. 318 (books.google.com).
- K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie. John Wiley & Sons, 2020, ISBN 978-3-527-82112-9, S. 192 (books.google.com).
- Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition: Arenes and Arynes. Georg Thieme Verlag, 2014, ISBN 978-3-13-179974-6, S. 29 (books.google.de).
- Andrew L. Ferguson, Pablo G. Debenedetti, Athanassios Z. Panagiotopoulos: Solubility and Molecular Conformations of n -Alkane Chains in Water. In: The Journal of Physical Chemistry B. Band 113, Nr. 18, 7. Mai 2009, S. 6405–6414, doi:10.1021/jp811229q.
- Constantine Tsonopoulos: Thermodynamic analysis of the mutual solubilities of hydrocarbons and water. In: Fluid Phase Equilibria. Band 186, Nr. 1–2, August 2001, S. 185–206, doi:10.1016/S0378-3812(01)00520-9.
- Arnold F. Holleman, Nils Wiberg: Grundlagen und Hauptgruppenelemente. Walter de Gruyter & Co KG, 2016, ISBN 978-3-11-049585-0, S. 1038 (books.google.com).
- Thomas Wurm: Chemie für Einsteiger und Durchsteiger. John Wiley & Sons, 2019, ISBN 978-3-527-82090-0, S. 187 ff. (books.google.com).
- Catherine E. Housecroft, Alan G. Sharpe: Inorganic Chemistry, 4. Auflage, Pearson Education, Amsterdam, 2012, S. 433f.
- Stefanie Federle, Stefanie Hergesell, Sebastian Schubert: Die Stoffklassen der organischen Chemie: Praktisch und kompakt von Studenten erklärt. Springer-Verlag, 2017, ISBN 978-3-662-54968-1, S. 15 (books.google.com).
- Martin Stallmann: CO2-Emissionsfaktoren für fossile Brennstoffe. Umweltbundesamt, 2022, S. 28 (umweltbundesamt.de).
- Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. John Wiley & Sons, 2007, ISBN 978-3-527-31540-6.
- Verordnung über die Lenkungsabgabe auf flüchtigen organischen Verbindungen (VOCV). In: Fedlex. Abgerufen am 10. März 2024.
- Johanna Appelhans, Christian Böttcher, Kai Keßler, Christian Mielke, Anja Nowack, Katja Purr, Anja Schwetje, Diana Sorg, Jens Tambke: Unterschätztes Treibhausgas Methan. Umweltbundesamt, August 2022 (umweltbundesamt.de [abgerufen am 10. März 2024]).