Kaliummolybdat
Kaliummolybdat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Molybdate.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
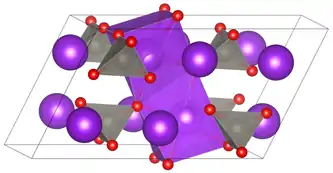 | |||||||||||||||||||
| _ K+ _ Mo6+ _ O2− | |||||||||||||||||||
| Kristallsystem |
monoklin | ||||||||||||||||||
| Raumgruppe |
C2/m (Nr. 12) | ||||||||||||||||||
| Gitterparameter |
| ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliummolybdat | ||||||||||||||||||
| Andere Namen |
Dikaliummolybdat | ||||||||||||||||||
| Verhältnisformel | K2MoO4 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 238,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
2,34 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (646 g·l−1 bei 25 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Kaliummolybdat kann durch Reaktion einer wässrigen Lösung von Kaliumhydroxid mit Ammoniumheptamolybdat gewonnen werden.[4]
Eigenschaften
Kaliummolybdat ist ein farbloser Feststoff.[2] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12)[1] isomorph zu Kaliumwolframat.[5] Bei höheren Temperaturen oder Drücken findet ein Phasenwechsel in eine andere Struktur statt.[6][7]
Verwendung
Kaliummolybdat wird in der chemischen Forschung[8] eingesetzt und als Nahrungsergänzungsmittel untersucht.[4]
Einzelnachweise
- B. M. Gatehouse, P. Leverett: Crystal structure of potassium molybdate, K2MoO4. In: Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1969, S. 849, doi:10.1039/J19690000849.
- Datenblatt Potassium molybdate, 98% bei Sigma-Aldrich, abgerufen am 12. Juni 2019 (PDF).
- Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 328 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michio Inagaki, Yasuo Nishikawa, Motosugu Sakai: Synthesis and phase transitions of K2MoO4. In: Journal of Materials Chemistry. 2, 1992, S. 323, doi:10.1039/JM9920200323.
- F. X. N. M. Kools, A. S. Koster, G. D. Rieck: The Structures of Potassium, Rubidium and Caesium Molybdate and Tungstate. In: Acta Cryst. B26, 1970, S. 19741–1977, doi:10.1107/S0567740870005277.
- A. J. van den Berg, H. Overeijnder, F. Tuinstra: The average structure of K2MoO4 in the incommensurate phase at 633 K. In: Acta Crystallographica Section C Crystal Structure Communications. 39, S. 678, doi:10.1107/S0108270183005909.
- W. Paraguassu, G.D. Saraiva, S. Guerini, P.T.C. Freire, B.T.O. Abagaro, J. Mendes Filho: Pressure-induced phase transition on K2MoO4: A Raman scattering study and ab initio calculations. In: Journal of Solid State Chemistry. 196, 2012, S. 197, doi:10.1016/j.jssc.2012.06.021.
- Datenblatt Potassium molybdenum oxide, anhydrous, 99.8% (metals basis) bei Alfa Aesar, abgerufen am 12. Juni 2019 (Seite nicht mehr abrufbar).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.