Kaliummanganat
Kaliummanganat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Manganate.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
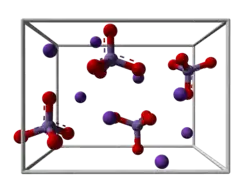 | |||||||||||||||||||
| _ K+ _ Mn6+ _ O2− | |||||||||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliummanganat | ||||||||||||||||||
| Andere Namen |
Kaliummanganat(VI) | ||||||||||||||||||
| Verhältnisformel | K2MnO4 | ||||||||||||||||||
| Kurzbeschreibung |
grüner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Kaliummanganat kann durch Reaktion von Kaliumpermanganat mit Kaliumhydroxid gewonnen werden.[4]
Es kann auch durch Reaktion von Mangan(II)-Verbindungen oder Mangan(IV)-oxid mit Kaliumhydroxid und Sauerstoff bzw. Luft oder durch Reaktion von Kaliumnitrat mit Kaliumcarbonat gewonnen werden.
Eigenschaften
Kaliummanganat ist ein grüner paramagnetischer, metallisch glänzender Feststoff.[5] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62).[4][6] Er ist stabil in alkalischer wässriger Lösung, aber in neutraler oder saurer Lösung zersetzt er sich in Kaliumpermanganat und Mangan(IV)-oxid.[1]
Verwendung
Es wird als selektives Oxidationsmittel verwendet.[2]
Einzelnachweise
- Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994, ISBN 978-3-11-011451-5, S. 889 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Potassium manganate bei Sigma-Aldrich, abgerufen am 10. September 2015 (PDF).
- R. S. Nyholm and P. R. Woolliams: Manganates(VI). In: William L. Jolly (Hrsg.): Inorganic Syntheses. Band 11. McGraw-Hill Book Company, Inc., 1968, S. 56–61 (englisch).
- R. D. W. Kemmitt, R. D. Peacock: The Chemistry of Manganese, Technetium and Rhenium Pergamon Texts in Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-8762-4, S. 809 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 978-3-11-022567-9, S. 833 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gus J. Palenik: Crystal structure of potassium manganate. In: Inorganic Chemistry. 6, 1967, S. 507–511, doi:10.1021/ic50049a016.

