Jourdan-Ullmann-Reaktion
Die Jourdan-Ullmann-Reaktion ist eine Namensreaktion der organischen Chemie, bei der ein Arylhalogenid unter Kupferkatalyse mit einem Anilin oder Anilinderivat zu einem Diarylamin umgesetzt wird.[1] Die Reaktion wurde erstmals 1885 von Friedrich Jourdan beschrieben[2] und ab 1902 von Fritz Ullmann und seiner Assistentin und späteren Ehefrau Irmi Goldberg erweitert.[3][4]
Die Reaktion wird auch als Ullmann-Reaktion, Ullmann-Kondensation oder Ullmann-Goldberg-Kondensation bezeichnet.
Reaktion
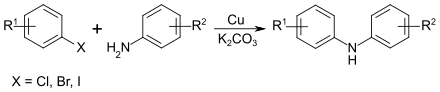
Die Reaktivität der Arylhalogenide bei der Jourdan-Ullmann-Reaktion wird durch elektronenziehende Substituenten erhöht, wobei die Reaktivität der Halogenide in der Reihe I > Br > Cl > F abnimmt. Die Reaktion wird durch elementares Kupfer in Gegenwart von Sauerstoff, aber auch durch Kupfersalze, wie Kupfer(II)-acetat und Kupfer(I)-iodid katalysiert. Entscheidend ist die Gegenwart einer Base, wie z. B. Kaliumcarbonat, um den entstehenden Halogenwasserstoff zu neutralisieren.[1] Die Reaktion kann sowohl in hochsiedenden aprotischen Lösungsmitteln (z. B. Nitrobenzol, DMSO) als auch in Wasser durchgeführt werden.[5][6]
Reaktionsmechanismus
Ein möglicher Reaktionsmechanismus für die Jourdan-Ullmann-Reaktion ist eine nukleophile aromatische Substitution des Halogens durch das aromatische Amin:[1]

Alternativ wird auch ein Prozess über ein freies Radikal, das durch die reduktive Dehalogenierung des Arylhalogenids mit Kupfer entsteht, diskutiert.[1]

Anwendung
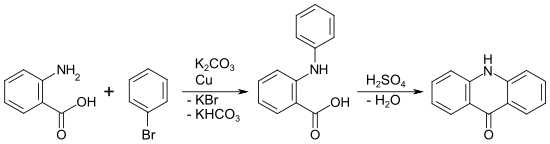
Anwendung findet die Jourdan-Ullmann-Reaktion bei der Synthese von Acridon. Im ersten Schritt werden Anthranilsäure und Brombenzol in Gegenwart von Kupfer und Kaliumcarbonat zur Phenylanthranilsäure kondensiert. Die Phenylanthranilsäure cyclisiert mit Schwefelsäure zu Acridon.[7]
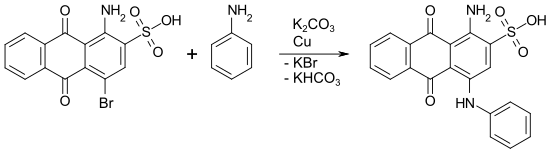
Die Jourdan-Ullmann-Reaktion ist die wichtigste industrielle Methode, um Arylamino-Substituenten in das Anthrachinon-Gerüst einzuführen. Dies ist der zentrale Reaktionsschritt bei der Produktion vieler blauer und grüner Direktfarbstoffe, Säurefarbstoffe und Reaktivfarbstoffe ausgehend von der Bromaminsäure (1-Amino-4-brom-9,10-anthrachinon-2-sulfonsäure).[6]
Beispiel: Synthese von C.I. Acid Blue 25 durch Umsetzung von Bromaminsäure mit Anilin
Verwandte Reaktionen
- Synthese von Diarylether durch Umsetzung von Arylhalogeniden mit Phenolen unter Kupferkatalyse (Ullmann-Diarylethersynthese)
- Synthese von Biarylen aus Arylhalogeniden unter Kupferkatalyse (Ullmann-Reaktion)
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc., Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1569–1575.
- Friedrich Jourdan: Neue Synthesen von Derivaten des Hydroacridins und Acridins. In: Berichte der deutschen chemischen Gesellschaft. Band 18, Nr. 1, Januar 1885, S. 1444, doi:10.1002/cber.188501801312.
- F. Ullmann: Ueber eine neue Bildungsweise von Diphenylaminderivaten. In: Berichte der deutschen chemischen Gesellschaft. Band 36, Nr. 2, April 1903, S. 2382, doi:10.1002/cber.190303602174.
- Irma Goldberg: Ueber Phenylirungen bei Gegenwart von Kupfer als Katalysator. In: Berichte der deutschen chemischen Gesellschaft. Band 39, Nr. 2, März 1906, S. 1691, doi:10.1002/cber.19060390298.
- Chao-Hun Li, Tak-Hang Chan: Comprehensive Organic Reactions in Aqueous Media. 2. Auflage. John Wiley & Sons, Inc., Hoboken, New Jersey 2007, ISBN 978-0-471-76129-7, S. 163.
- Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3, S. 274 (eingeschränkte Vorschau in der Google-Buchsuche).
- Werner Kunz, Eberhard Nonnenmacher: Reaktionen der organischen Chemie. 6. Auflage. Wiley-VHC, Weinheim 1997, S. 18 (eingeschränkte Vorschau in der Google-Buchsuche).