Ipsdienol
Ipsdienol ist eine chemische Verbindung aus der Gruppe der Terpenalkohole und ein Pheromon verschiedener Borkenkäfer-Arten der Gattung Ips.[2]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
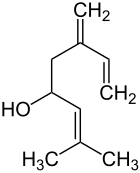 | ||||||||||||||||
| Ipsdienol ohne Angabe der Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ipsdienol | |||||||||||||||
| Andere Namen |
2-Methyl-6-methylen-2,7-octadien-4-ol | |||||||||||||||
| Summenformel | C10H16O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 152,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,9 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt |
-25 °[3] | |||||||||||||||
| Siedepunkt |
233 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[3] | |||||||||||||||
| Brechungsindex |
1,47[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Isomere
Ipsdienol hat ein stereogenes Zentrum am Kohlenstoffatom der Position 4 und tritt somit in Form zweier Enantiomere auf: (R)-(−)-Ipsdienol und (S)-(+)-Ipsdienol.
| Isomere von Ipsdienol | ||
| Name | (S)-Ipsdienol | (R)-Ipsdienol |
| Andere Namen | (+)-Ipsdienol | (−)-Ipsdienol |
| Strukturformel | -Ipsdienol_Structural_Formula.svg.png.webp) | -Ipsdienol_Structural_Formula.svg.png.webp) |
| CAS-Nummer | 35628-00-3 | 60894-97-5 |
| 14434-41-4 (unspez.) | ||
| EG-Nummer | 609-154-9 | – |
| 238-408-8 (unspez.) | ||
| ECHA-Infocard | 100.128.974 | – |
| 100.034.901 (unspez.) | ||
| PubChem | 92301 | 181296 |
| 85734 (unspez.) | ||
| Wikidata | Q13422964 | Q27158231 |
| Q55756695 (unspez.) | ||
Vorkommen
Das (R)-Enantiomer wird von Ips confusus genutzt, einem Schädling der Gelb-Kiefer, während das (S)-Enantiomer ein Pheromon von Ips paraconfusus ist.[4]
 Borkenkäfer (Ips confusus)
Borkenkäfer (Ips confusus) Borkenkäfer (Ips paraconfusus)
Borkenkäfer (Ips paraconfusus)
Es ist auch als Pheromon verschiedener Arten von Borkenkäfern (Scolytidae) bekannt. Darüber hinaus wurde in neun Orchideenarten eine hohen Anteil an Ipsdienol in ihrem Blütenduft nachgewiesen. Synthetisches, racemisches Ipsdienol lockte in Feldversuchen in Panama, Mexiko und Peru mehrere Arten von euglossischen Bienen an.[5]
Gewinnung und Darstellung
(R)-(-)-Ipsdienol und sein Antipode können aus (R)-(+)-Glyceraldehydacetonid bzw. (R)-(+)-Apfelsäure synthetisiert werden. Damit wurde die S-Konfiguration des natürlich vorkommenden (+)-Ipsdienol nachgewiesen.[6] Daneben sind noch einige weitere Syntheseverfahren bekannt. So zum Beispiel die Reaktion von 1,4-Dibrom-2-(brommethyl)but-2-en mit Zink, gefolgt von der Behandlung mit 3-Methylbutanal und 3-Methylbut-2-enal, ergibt racemisches Ipsenol und Ipsdienol in 64 und 50 % Ausbeute.[7][8]
Einzelnachweise
- A.F. Kydonieus: Insect Suppression with Controlled Release Pheromone Systems. CRC Press, 2019, ISBN 978-1-351-09042-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Ipsdienol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Februar 2015.
- Santa Cruz Biotechnology: Ipsdienol | CAS 14434-41-4 | SCBT - Santa Cruz Biotechnology, abgerufen am 29. Oktober 2023
- Jean Pierre Vité, Wittko Francke: Waldschutz gegen Borkenkäfer: Vom Fangbaum zur Falle. In: Chemie in unserer Zeit. Band 19, Nr. 1, Februar 1985, S. 11–21, doi:10.1002/ciuz.19850190103.
- W. Mark Whitten, Harold G. Hills, Norris H. Williams: Occurrence of ipsdienol in floral fragrances. In: Phytochemistry. Band 27, Nr. 9, 1988, S. 2759–2760, doi:10.1016/0031-9422(88)80657-5.
- K. Mori, T. Takigawa, T. Matsuo: Synthesis of optically active forms of ipsdienol and ipsenol: The pheromone components of ips bark beetles. In: Tetrahedron. Band 35, Nr. 8, 1979, S. 933–940, doi:10.1016/S0040-4020(01)93705-6.
- José Marco‐Contelles: The Synthesis of Ipsenol and Ipsdienol: A Review (1968–2020). In: The Chemical Record. Band 21, Nr. 4, 2021, S. 858–878, doi:10.1002/tcr.202000160.
- Peter A. A. Klusener, Willem Kulik, Lambert Brandsma: Regiospecific functionalization of dimetalated isopropenylacetylene, a synthetic equivalent of the isoprene "anion". An efficient synthesis of the bark beetle pheromones (.+-.)-ipsenol and (.+-.)-ipsdienol. In: The Journal of Organic Chemistry. Band 52, Nr. 23, 1987, S. 5261–5266, doi:10.1021/jo00232a037.
