Iodazid
Iodazid, IN3, ist eine farblose bis gelbe, äußerst explosive, feste chemische Verbindung aus der Gruppe der Stickstoffhalogenide. Formal gehört es zu den Inter-Pseudohalogenen. Iodazid ist nicht zu verwechseln mit dem ebenfalls explosiven Iodstickstoff, NI3.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
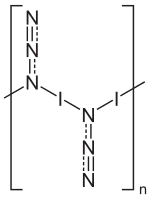 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Iodazid | ||||||||||||
| Summenformel | IN3 | ||||||||||||
| Kurzbeschreibung |
farbloser, hochexplosiver Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 168,92 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dampfdruck |
2 Torr (25 °C)[2] | ||||||||||||
| Löslichkeit |
Zersetzung in Wasser[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Zum ersten Mal wurde Iodazid um das Jahr 1900 von den Chemikern A. Hantzsch und M. Schumann in sehr unbeständigen etherischen Lösungen und in Form von mit Iod verunreinigten Kristallen durch Reaktion von Iod mit Silberazid erhalten.[6]
Gewinnung und Darstellung
Iodazid kann durch Reaktion von Silberazid AgN3 mit Iod in einer CFCl3-Lösung gewonnen werden.
Da sich Silberazid nur feucht gefahrlos handhaben lässt, Spuren von Wasser aber bereits die Zersetzung des Iodazids bewirken, gelingt dessen Herstellung am besten, wenn vor der Umsetzung mit Iod zur Suspension des Silberazids in Dichlormethan ein Trocknungsmittel gegeben wird. Auf diese Weise erhält man eine reine Lösung von Iodazid, aus der sich beim vorsichtigen Verdampfen des Lösungsmittels nadelförmige, goldglänzende Kristalle isolieren lassen.[3]
Für die Anwendung als Reagenz kann es in situ aus Natriumazid und Iodmonochlorid in Acetonitril[7] oder aus N-Iodsuccinimid und Stickstoffwasserstoffsäure im Methylenchlorid[8] erhalten werden.
Eigenschaften
Iodazid liegt in Form eines eindimensionalen Polymers vor.[9] Hierbei werden zwei polymorphe Formen gebildet, die beide ein orthorhombisches Kristallgitter mit der Raumgruppe Pbam (Raumgruppen-Nr. 55) bilden.[9] Die Verbindung zeigt keinen Schmelzpunkt. Der Sublimationspunkt liegt bei 760 Torr bei 24 °C.[10][11] In der Gasphase konnte mittels Elektronendiffraktionsuntersuchungen eine monomere Struktur nachgewiesen werden.[12] Die große Reaktionsfähigkeit von Iodazid bei relativ hoher Stabilität beruht auf der Polarität der I–N-Bindung. Die durch Substitution mit Iodazid eingeführte N3-Gruppe kann wegen ihres hohen Energieinhalts Folgereaktionen eingehen.[3]
Die isolierte Verbindung ist stark schlag- und reibempfindlich.[6][13] Zur Charakterisierung der Explosionsfähigkeit wurden die folgenden Kenngrößen ermittelt:[2]
| Normalgasvolumen | 265 l·kg−1[2] |
| Explosionswärme | 2091 kJ·kg−1[2] |
| Bleiblockausbauchung | 14,0 cm3·g−1[2] |
Diese liegen signifikant niedriger im Vergleich zu klassischen Explosivstoffen wie TNT oder Hexogen aber auch zu Acetonperoxid. Ein Umgang mit der Verbindung in verdünnter Lösung wird als sicher angesehen.[10][11]
Verwendung
Trotz seiner hohen Brisanz wird Iodazid als Reagenz in der chemischen Synthese verwendet werden.[14] Aldehyde können mittels Iodazid in Carbonsäureazide überführt werden.[15]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7.
Weblinks
Einzelnachweise
- Eintrag zu Iodazid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Buzek, P.; Klapötke, T.M.; Von Ragué Schleyer, P.; Tornieporth-Oetting, I.C.; White, P.S.: Iodazid in Angew. Chem. 105 (1993) 289–290, doi:10.1002/ange.19931050228
- Kurt Dehnicke: Die Chemie des Iodazids, Angewandte Chemie, 91(7), 1979, 527–534, doi:10.1002/ange.19790910704.
- Sorbe, G.: Gefahrstoffdatenbank - Sicherheitstechnische Kenndaten, ecomed SICHERHEIT, ecomed-Storck GmbH Landsberg am Lech, abgerufen am 25. März 2023.
- L. Roth, U. Weller: Gefährliche Chemische Reaktionen, Eintrag für Iodazid, Stand 70. Ergänzungslieferung 8/2013, ecomed Verlag Landsberg/Lech, ISBN 978-3-609-19587-2.
- A. Hantzsch, M. Schumann: Berichte der Deutschen Chemischen Gesellschaft, 33, 522, 1900.
- Hassner, A.; Levy, L. A.: Additions of Iodine Azide to Olefins. Stereospecific Introduction of Azide Functions in J. Am. Chem. Soc. 87 (1965) 4203–4204, doi:10.1021/ja01096a045.
- Hassner, A.: Synthesis of α-azidovinyl ketones from the iodine azide adducts of α,β-unsaturated ketones in J. Org. Chem. 36 (1971) 258–260, doi:10.1021/jo00801a004
- Lyhs, B.; Bläser, D.; Wölper, C.; Schulz, S.; Jansen, G.: Festkörperstrukturvergleich der Halogenazide XN3 (X=Cl, Br, I) in Angew. Chem. 124 (2012) 13031–13035, doi:10.1002/ange.201206028.
- Dehnicke, K.: Isolierung und Infrarotspektrum des Iodazids in Angew. Chem. 88 (1976) 612–613, doi:10.1002/ange.19760881808.
- Dehnicke, K.: Isolation and Infrared Spectrum of Iodine Azide in Angew. Chem. (Intern. Ed.) 15 (1976) 553–554, doi:10.1002/anie.197605531.
- Hargittai, M.; Molnár, J.; Klapötke, T. M.; Tornieporth-Oetting, I. C.; Kolonits, M.; Hargittai, I.: Iodine Azide. Molecular Structure from Gas-Phase Electron Diffraction in J. Phys. Chem. 98 (1994) 10095–10097 ,doi:10.1021/j100091a025.
- Urben, P.G.: Bretherick's Handbook of Reactive Chemical Hazards, 6th Ed., Vol. 1, Butterworth-Heinemann 1999, ISBN 0-7506-3605-X, S. 1713.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Iodine Azide, abgerufen am 8. August 2013.
- L. Marinescu, J. Thinggaard, B. Thomsen, M. Bols: Radical Azidonation of Aldehydes in J. Org. Chem. 68 (2003) 9453–9455, doi:10.1021/jo035163v.
