Inteine
Ein Intein ist eine Aminosäuresequenz eines Proteins, die sich selbst (autokatalytisch) aus diesem ausschneiden und die verbleibenden Stücke (Exteine) wieder durch eine Peptidbindung verknüpfen kann. Da einige Inteine ebenfalls eine Endonuklease enthalten, sind ihre codierenden Gene eine Form eigennütziger DNA.[1][2]
Eigenschaften
Bis heute wurden Inteine in allen drei Domänen (Superreichen) des Lebens gefunden (Eukaryoten, Bakterien und Archaeen), sowie bei Viren. Es sind mit Stand 2014 über 116 Inteine in Eukaryoten bekannt, 1137 in Bakterien und 381 in Archaeen sowie 243 in Viren einschließlich Bakteriophagen[3]. (2002 waren es noch 113 in Eukaryoten, 289 in Bakterien, 182 in Archaeen, und mit Stand 2005 lediglich 2 in Viren[4][5]) Die Längen betragen zwischen 138 und 844 Aminosäuren. Die meisten Inteine beinhalten eine Endonuklease-Domäne, die eine Rolle in der Inteinverbreitung spielt. Die Endonuklease spaltet nur inteinfreie Allele des inteinhaltigen Gens (auf dem homologen Chromosom), wodurch es bei der Reparatur des Doppelstrangbruches zu einer Einführung der intein-codierenden DNA in diese Schnittstelle durch das DNA-Reparatur-System kommt. Durch diesen Prozess wurde das Intein vermehrt und die Zelle ist homozygot für das inteinhaltige Gen, wodurch bei der Zellteilung das Intein automatisch an alle Tochterzellen weitervermehrt wird. Deshalb werden Inteine (oder besser die Gensegmente, die für die Inteine codieren) als „eigennützige genetische Elemente“ bezeichnet. Allerdings wäre es präziser, sie als parasitär zu bezeichnen.
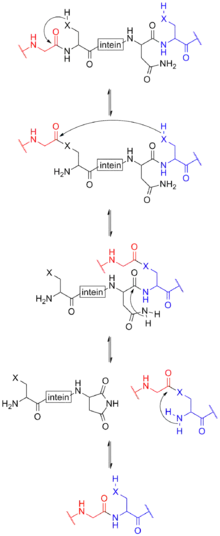
Inteine werden in Analogie zu den beim Spleißen herausgeschnittenen RNA-Sequenzen auch als Proteinintrone bezeichnet, die Autoproteolyse und Relegation als Proteinspleißen.[6] Es sind bisher drei Mechanismen bei Inteinen beschrieben worden.[7]
Intein-vermitteltes Proteinspleißen tritt nach der Translation der mRNA in ein Protein auf. Dieses Vorläuferprotein (pre-cursor) enthält mindestens drei Segmente: Ein N-Extein, ein Intein und ein C-Extein. Nach dem Spleißvorgang wird das Resultat ebenfalls als Extein bezeichnet.
Inteinbenennung
Der erste Teil des Inteinnamens besteht aus dem wissenschaftlichen Namen des Organismus, in dem es gefunden wurde. Der zweite Teil basiert auf dem Gen oder Extein, in dem es vorkommt. Zum Beispiel würde das zweite Intein aus Thermococcus fumicolans im Gen der DNA-Polymerase als Tfu Pol-2 bezeichnet werden. Bei der Nummerierung der Inteine wird bei dem 5'-Ende des Gens begonnen.
Getrennte Inteine
In einigen Fällen liegen Inteine eines Vorläuferproteins auf verschiedenen Genen. Hierbei spricht man von getrennten Inteinen (englisch split inteins). Ein Beispiel hierfür ist die katalytische Untereinheit alpha der DNA-Polymerase III in Cyanobakterien, wie zum Beispiel Synechocystis sp. (Bezeichnung Ssp DnaE). Das Protein der DnaE wird durch zwei über 700 kbp entfernte Gene codiert. Eines enthält den N-Terminus (dnaE-n) und eine 123 Aminosäuren lange Inteinsequenz, und das zweite codiert für eine zweite 36 AS lange Inteinsequenz und den C-Terminus (dnaE-c). Durch Transspleißen werden die beiden Proteinteile zu einem funktionalen Protein zusammengeführt.
Anwendungen
Inteine werden in der Biotechnologie zum Beispiel bei der Proteinsynthese genutzt, um Proteinsegmente im Zuge einer Molekülmarkierung selektiv, zum Beispiel mit schweren Atomen, zu markieren. Dies ist bei der Untersuchung von großen Proteinen mittels NMR hilfreich. Außerdem können Polypeptide miteinander verknüpft werden (Proteinligation). So wird es unter anderem möglich, zytotoxische Proteine zu exprimieren, Zyklisierungen durchzuführen (zur Stabilitätserhöhung) und Proteinstrukturen zu untersuchen.
Manche Inteine können durch Thiole oder durch Absenken des pH-Werts ausgelöst werden.[8][9][10]
Geschichte
Das erste Intein wurde 1988 durch einen Sequenzvergleich der ATPasen von Neurospora crassa, der Karotte und der Bäckerhefe entdeckt.[11][12] Die Inteinsequenz wurde dabei irrtümlich als Calcium-Ionentransporter klassifiziert.[13] Im Jahr 1990 wurde der Verlust der Inteinsequenz nach der Translation beschrieben.[14]
Einzelnachweise
- Kristen Swithers, Shannon M. Soucy, J. Peter Gogarten: The Role of Reticulate Evolution in Creating Innovation and Complexity. In: International Journal of Evolutionary Biology. Band 2012, 2012, doi:10.1155/2012/418964, PMID 22844638 (hindawi.com).
- S. Elleuche et al.: Proteinspleißen: Inteine – die “Introns” der Proteine und ihre biotechnologische Anwendung. In: Biologie in unserer Zeit, Volume 36, Issue 5, Oktober 2006, Seiten 294–301, doi:10.1002/biuz.200610314.
- O. Novikova et al.: Enigmatic Distribution, Evolution, and Function of Inteins., Figure 2. In: J Biol Chem. vom 23. Mai 2014; 289(21): 14490–14497. doi:10.1074/jbc.R114.548255. PMC 4031506 (freier Volltext)
- Inbase, F. B. Perler: InBase: the Intein Database. In: Nucleic Acids Research. 30. Jahrgang, Nr. 1, 2002, S. 383–384, doi:10.1093/nar/30.1.383, PMID 11752343, PMC 99080 (freier Volltext).
- H. Ogata et al.: A new example of viral intein in Mimivirus. In: BioMed Central Virology Journal 2005 2:8, doi:10.1186/1743-422X-2-8
- Y. Anraku, R. Mizutani, Y. Satow: Protein splicing: its discovery and structural insight into novel chemical mechanisms. In: IUBMB Life. Band 57, Nr. 8, 2005, S. 563–574, doi:10.1080/15216540500215499, PMID 16118114.
- G. Volkmann, H. D. Mootz: Recent progress in intein research: from mechanism to directed evolution and applications. In: Cellular and molecular life sciences : CMLS. Band 70, Nummer 7, April 2013, S. 1185–1206. doi:10.1007/s00018-012-1120-4. PMID 22926412.
- S. Chong, F. B. Mersha, D. G. Comb, M. E. Scott, D. Landry, L. M. Vence, F. B. Perler, J. Benner, R. B. Kucera, C. A. Hirvonen, J. J. Pelletier, H. Paulus, M. Q. Xu: Single-column purification of free recombinant proteins using a self-cleavable affinity tag derived from a protein splicing element. In: Gene. Band 192(2), 1997, S. 271–281. PMID 9224900.
- S. Chong, G. E. Montello, A. Zhang, E. J. Cantor, W. Liao, M. Q. Xu, J. Benner: Utilizing the C-terminal cleavage activity of a protein splicing element to purify recombinant proteins in a single chromatographic step. In: Nucleic Acids Res. Band 26(22), 1998, S. 5109–5115. PMID 9801307; PMC 147948 (freier Volltext).
- D. W. Wood, W. Wu, G. Belfort, V. Derbyshire, M. Belfort: A genetic system yields self-cleaving inteins for bioseparations. In: Nat Biotechnol. Band 17(9), 1999, S. 889–892. PMID 10471931.
- E. J. Bowman, K. Tenney, B. J. Bowman: Isolation of genes encoding the Neurospora vacuolar ATPase. Analysis of vma-1 encoding the 67-kDa subunit reveals homology to other ATPases. In: The Journal of biological chemistry. Band 263, Nummer 28, Oktober 1988, S. 13994–14001, PMID 2971651.
- L. Zimniak, P. Dittrich, J. P. Gogarten, H. Kibak, L. Taiz: The cDNA sequence of the 69-kDa subunit of the carrot vacuolar H+-ATPase. Homology to the beta-chain of F0F1-ATPases. In: The Journal of biological chemistry. Band 263, Nummer 19, Juli 1988, S. 9102–9112, PMID 2897965.
- C. K. Shih, R. Wagner, S. Feinstein, C. Kanik-Ennulat, N. Neff: A dominant trifluoperazine resistance gene from Saccharomyces cerevisiae has homology with F0F1 ATP synthase and confers calcium-sensitive growth. In: Molecular and cellular biology. Band 8, Nummer 8, August 1988, S. 3094–3103, PMID 2905423, PMC 363536 (freier Volltext).
- R. Hirata, Y. Ohsumk, A. Nakano, H. Kawasaki, K. Suzuki, Y. Anraku: Molecular structure of a gene, VMA1, encoding the catalytic subunit of H(+)-translocating adenosine triphosphatase from vacuolar membranes of Saccharomyces cerevisiae. In: The Journal of biological chemistry. Band 265, Nummer 12, April 1990, S. 6726–6733, PMID 2139027.