Hippocampus
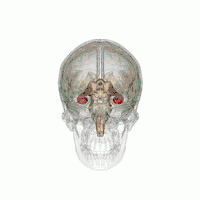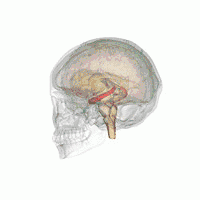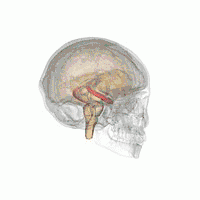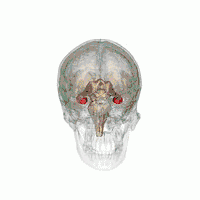
Der Hippocampus (Plural Hippocampi) ist ein Teil des Gehirns, genauer: des erstmals bei Reptilien auftretenden Archicortex.[1] Er befindet sich am inneren Rand des Temporallappens und ist eine zentrale Schaltstation des limbischen Systems. Es gibt einen Hippocampus pro Hemisphäre.
Wortherkunft


Ab 1706 wurde ein Hirnteil nach dem Seepferdchen (lateinisch Hippocampus) benannt. Das Seepferdchen wurde seinerseits seit den 1570er Jahren in latinisierter Form nach dem Meeresungeheuer Hippokamp aus der griechischen Mythologie bezeichnet, dessen vordere Hälfte ein Pferd, der hintere Teil ein Fisch ist. Der Name dieses Fabelwesens (altgriechisch ἱππόκαμπος hippokampos) ist zusammengesetzt aus hippos ‚Pferd‘ und kampos ‚Seeungeheuer‘.[2][3]
Der Hippocampus ähnelt insgesamt einem Seepferdchen ohne Kopf (siehe Abbildung).[4]
Anatomie

Ansicht von unten (die Stirn liegt im Bild oben)
Der Hippocampus befindet sich im medial gelegenen Teil des Telencephalons (Endhirn) und bildet den sogenannten Archicortex.
Zum Hippocampus gehören mehrere Strukturen, weshalb man auch von einer Hippocampusformation oder Formatio hippocampi spricht:
- Gyrus dentatus
- Cornu Ammonis (Ammonshorn, Hippocampus proprius)
- Subiculum
Zytoarchitektonik
Der Gyrus dentatus stellt die Eingangsstation des Hippocampus dar. Seine Nervenzellkörper liegen im Körnerzellband (Stratum granulare). Die Hauptzellen sind erregende, glutamaterge Körnerzellen, die ihre Dendriten in die Molekularschicht (Stratum moleculare) nach außen entsenden. Außerdem gibt es eine Reihe unterschiedlicher hemmender, GABAerger Interneuronen, die durch ihre Morphologie, damit auch durch ihre Ein- und Ausgänge und ferner durch kennzeichnende Proteine unterschieden werden. Die Molekularschicht lässt sich unterteilen in die innere und äußere Molekularschicht. In beiden Teilen befinden sich kaum Nervenzellkörper, sondern nur Nervenfasern. Die Eingänge der beiden Schichten unterscheiden sich jedoch und können mit verschiedenen Färbungen visualisiert werden (siehe unten). Innerhalb des Bogens der Körnerzellschicht befindet sich der Hilus, auch Lamina multiformis genannt. Er enthält einige Interneurone, vor allem aber die Axone der Körnerzellen, die sogenannten Moosfasern (Beachte: Diese Axone haben bis auf den Namen nichts gemeinsam mit den Moosfasern im Kleinhirn).
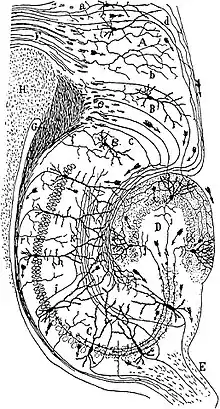
von Santiago Ramon y Cajal (1911)
Der eigentliche Hippocampus (Hippocampus proprius) ist, als archicorticale Struktur, ebenfalls dreischichtig. Ähnlich wie beim Gyrus dentatus liegen die Nervenzellkörper in einer Schicht, der Pyramidenzellschicht (Stratum pyramidale). Die Hauptzellen sind auch hier glutamaterge Pyramidenzellen, die Dendriten radial sowohl nach innen als auch nach außen schicken, und es gibt eine ähnliche Vielfalt an Interneuronen. Als Eingangsschichten gliedern sich nach außen an die Pyramidenzellschicht das breite Stratum radiatum und das schmalere Stratum lacunosum-moleculare an, nach innen das Stratum oriens, welches die Zellkörper der hemmenden Korbzellen enthält. In seiner tangentialen Richtung wird der Hippocampus proprius unterteilt in die CA1- bis CA4-Regionen (von Cornu Ammonis), wobei nur die CA1- und die CA3-Region tatsächlich anatomisch und funktional von Bedeutung sind.
Das Subiculum ist das Übergangsfeld vom dreischichtigen, archicorticalen Hippocampus zum sechsschichtigen Neocortex. Es liegt zwischen der CA1-Region und dem Cortex entorhinalis.
Verbindungen

CA Cornu Ammonis
DG Gyrus dentatus

In der Hippocampusformation sind erregende Neuronen in einer Kette hintereinandergeschaltet. Die Haupteingangsstation für kortikale Afferenzen ist die äußere Molekularschicht des Gyrus dentatus. Hier treffen, als sogenannter Tractus perforans, die Axone vom Cortex entorhinalis ein. Sie verschalten auf die ebenfalls erregenden Körnerzellen; daneben aber auch auf einige der verschiedenen Klassen von hemmenden Interneuronen (Vorwärtshemmung). Innerhalb des Gyrus dentatus bewirken andere Interneuronen, die Korb- und Kerzenleuchterzellen, eine Rückwärtshemmung, d. h., sie empfangen Eingänge von Körnerzellen und schalten auf deren Somata bzw. Axonhügel zurück. In der inneren Molekularschicht erhalten die Körnerzellen rückgekoppelte Afferenzen anderer Körnerzellen sowie aus der CA4-Region des Hippocampus proprius (assoziative Fasern), sowie commissurale Afferenzen aus dem Gyrus dentatus der anderen Hemisphäre.
Die Körnerzellen projizieren über die Moosfasern in das innere Stratum radiatum der CA3-Region des Hippocampus proprius auf die dortigen Pyramidenzellen, die ihrerseits erregend sind. Auch hier gibt es durch Interneuronen wieder Vorwärts- und Rückwärtshemmungen. Weitere Afferenzen tauschen sich zwischen den CA3-Regionen beider Hemisphären aus; sie enden im äußeren Stratum radiatum. Die Pyramidenzellen entsenden Axone in den Fornix, der die Hippocampusformation verlässt und verschiedene Kerne des Hirnstamms erreicht (u. a. Corpora mamillaria, Substantia nigra, Locus caeruleus).
Abzweigungen derselben Axone, die Schaffer-Kollateralen, verknüpfen die Kette weiter bis in die CA1-Region, wo sie wiederum an Pyramidenzellen enden. Außerdem erreichen Axone des Cortex entorhinalis das Stratum lacunosum-moleculare der CA1-Region. Die Axone der CA1-Pyramidenzellen bilden einen weiteren Teil des Fornix, außerdem projizieren sie in das Subiculum. Diese Projektion ist der Haupteingang des Subiculums. Daneben erhält es Afferenzen aus dem Cortex perirhinalis und Cortex entorhinalis. Seinerseits projiziert es in die Großhirnrinde beider Seiten zurück, außerdem in den Nucleus accumbens, die Amygdala, den präfrontalen Cortex und den Hypothalamus.
Über die Projektion des Fornix in die Corpora mamillaria ist der Hippocampus eingebunden in den Papez-Kreis, der von James W. Papez 1937 beschrieben und als neuronale Grundlage von Emotionen postuliert wurde. Der Papez-Kreis schließt sich über den Thalamus, den Gyrus cinguli und den Cortex entorhinalis zurück zur Hippocampusformation.
Die gesamte Hippocampusformation erhält außerdem Afferenzen neuromodulatorischer Bahnen. Cholinerge Neuronen im Septum pellucidum entsenden ihre Axone hierhin, serotoninerge Neuronen der medialen Raphe und Noradrenalin-haltige aus dem Locus caeruleus. Eine sehr schwache dopaminerge Projektion aus dem ventralen Tegmentum ist histochemisch nur schwer nachzuweisen.
Elektrische Aktivität
Während der Lokomotion und im REM-Schlaf ist die Aktivität im Hippocampus gering. In Wachzuständen ohne Lokomotion und Non-REM-Schlaf gibt es dagegen oft synchrone Aktivität großer Gruppen von Neuronen, die das extrazelluläre elektrische Potential (Feldpotential) im Hippocampus prägt. Charakteristisch sind sägezahnförmige Verläufe (englisch sharp wave) mit Perioden von einigen 100 ms, denen im oder kurz vor dem Maximum der Polarisation kurze Wellenpakete (ripple) überlagert sind. Synonyme Abkürzungen für diese Kombination sind SWR und SPW-R. Die Frequenz der Rippel, 100 bis über 200 Hz, ist von Art zu Art verschieden. Ein Rippel-Ereignis tritt fast immer in CA1 und CA3 und meist in beiden Hemisphären zeitgleich auf, wobei die Rippel selbst nicht synchron sind.
Funktionelle Aspekte
Im Hippocampus fließen Informationen verschiedener sensorischer Systeme zusammen, die verarbeitet und von dort zum Cortex zurückgesandt werden. Damit ist er enorm wichtig für die Gedächtniskonsolidierung, also die Überführung von Gedächtnisinhalten aus dem Kurzzeit- in das Langzeitgedächtnis. Menschen, bei denen beide Hippocampi entfernt oder zerstört wurden, können keine neuen Erinnerungen formen und weisen somit eine anterograde Amnesie auf. Alte Erinnerungen bleiben jedoch meist erhalten. Der Hippocampus wird somit als Struktur gesehen, die Erinnerungen generiert, während die Gedächtnisinhalte an verschiedenen anderen Stellen in der Großhirnrinde gespeichert werden.
Es wurde nachgewiesen, dass sich im erwachsenen Gehirn im Hippocampus neue Verbindungen zwischen bestehenden Nervenzellen bilden (synaptische Plastizität) und dass diese Neubildung mit dem Erwerb neuer Gedächtnisinhalte zusammenhängt. Prädestiniert für die Erforschung von molekularen Lernprozessen ist die Schaffer-Kollaterale, die Verbindung zwischen der CA3- und CA1-Region. Hier befinden sich spezielle Glutamat-Rezeptoren (NMDA), die an der Langzeit-Potenzierung beteiligt sind.
Bei Tieren hat der Hippocampus große Bedeutung für die räumliche Orientierung. Pyramidenzellen in CA1 repräsentieren jeweils einen Bereich einer Umgebung und werden daher auch Ortszellen genannt. Wenn sich das Tier bewegt, werden nacheinander verschiedene Zellen aktiv, wobei Zellen für benachbarte Orte nicht benachbart sind.[5] Auch sind teilweise für einen Ort je nach Bewegungsrichtung oder Ziel verschiedene Ortszellen zuständig. Ortszellen kodieren auch abstrakte Zustände, wie z. B. in welcher Phase eines komplexen Verhaltensablaufs ein Tier gerade ist oder ob gerade ein bestimmter Affekt vorliegt (Hunger, Neugier, Angst). Es gibt also im Gehirn keine topographisch organisierte Landkarte, die kognitive Repräsentation, auch kognitive Karte genannt, enthält jedoch topologische Informationen über die erlebte Umwelt. Zur kognitiven Leistung, Abstände zwischen definierten Orten zu repräsentieren, tragen die sogenannten Gitterzellen im entorhinalen Cortex bei. Menschen mit geschädigten Hippocampi können sich zwar im Alltagsleben orientieren, sind aber außerstande, Wegbeschreibungen zu geben.
Der Hippocampus ist auch für die Koordinierung der verschiedenen Gedächtnisinhalte verantwortlich. Beispielsweise besteht die „innere Karte“, die man z. B. von einer Stadt besitzt, aus zahlreichen Eindrücken, die auch zu unterschiedlichen Zeitpunkten gewonnen wurden. Im Hippocampus werden diese zusammengefügt, und man kann sich so orientieren.
Darüber hinaus spielt die Hippocampusformation auch eine wichtige Rolle für Emotionen:
- Personen mit (unipolarer) Depression zeigen reduziertes Volumen der Hippocampusformation.[6]
- Die Hippocampusformation ist einzigartig in ihrer Vulnerabilität für starke emotionale Stressoren; Tiermodelle zeigen hippocampale Atrophie als Effekt von chronischem emotionalen Stress (bedingt durch Absterben hippocampaler Neurone sowie Reduktion neuronaler Genese im Gyrus dentatus),[7] und Menschen mit schweren emotionalen Traumata (bspw. Vietnam-Veteranen oder Opfer sexuellen Kindesmissbrauchs) zeigen ebenfalls eine Volumenreduktion der Hippocampusformation.[8][9]
- Menschen mit abgeflachter Affektivität zeigen funktionelle Unterschiede in der Hippocampusformation bei der Verarbeitung emotionaler Stimuli.[10] Insbesondere funktionell-bildgebende Studien, die neuronale Korrelate von Emotion mit Musik untersuchen, berichten Aktivitätsunterschiede der Hippocampusformation im Zusammenhang mit musik-evozierten Emotionen.[11]
Neuropathologische Aspekte
Beim Menschen können verschiedene Erkrankungen zu einer Veränderung des Hippocampus führen. Allen voran können Abbauprozesse bei Demenzerkrankungen diese Hirnstruktur schädigen. Darüber hinaus spielt der Hippocampus eine wichtige Rolle bei der Entstehung von Epilepsieerkrankungen. Die Temporallappenepilepsie ist häufig mit einer mesialen temporalen Sklerose verbunden, die mittels bildgebender Verfahren (Magnetresonanztomographie) diagnostiziert werden kann. Die epilepsiechirurgische einseitige Entfernung der Hippokampusformation stellt eine Möglichkeit zur Behandlung von medikamentös unbeherrschbaren Anfällen dar. Rauschtrinken während der Adoleszenz steht im Verdacht, die Ausbildung des Hippocampus nachhaltig zu beeinträchtigen, was im Erwachsenenalter zu Vergesslichkeit und mangelnder räumlicher Orientierung führen kann.[12]
Neurogenese im Hippocampus
Der Gyrus dentatus des Hippocampus ist neben dem Bulbus olfactorius (bzw. der subventrikulären Zone) eine der beiden Strukturen im gesunden Säugetiergehirn, die zeitlebens neue Nervenzellen bilden. Diese Neurogenese von glutamatergen Körnerzellen wurde 1965 von Altman und Das an Ratten entdeckt und widerspricht dem zuvor über Jahrzehnte bestandenen Dogma, die Neuronen des Gehirns wären von der Geburt an vollständig. Trotzdem erregte die hippocampale Neurogenese erst seit den 1990er Jahren wissenschaftliche Aufmerksamkeit, als mithilfe der BrdU-Markierung sich teilender Zellen gezeigt werden konnte, dass Einflüsse wie Stress, Aktivierung des NMDA-Rezeptors, Laufen und reiche Umwelt die Teilungsrate der Zellen und/oder ihre Überlebensrate verändern können. Zahlreiche weitere Studien haben seitdem gezeigt, dass viele Neurotransmitter, Wachstumsfaktoren, Arzneistoffe, Drogen und Umweltfaktoren (darunter auch Lerntraining) die Neurogenese beeinflussen können. Da sich nur ein kleiner Teil der neu gebildeten Zellen zu Neuronen ausdifferenziert, ist es nötig, zwischen den Begriffen Zellproliferation (Mitose von neuronalen Stammzellen) und Neurogenese zu unterscheiden. Über Nagetiere hinaus wurde die Neurogenese im Hippocampus in dieser Zeit auch bei anderen Säugetieren gefunden, darunter 1998 auch beim Menschen.
Die Funktion der hippocampalen Neurogenese ist noch unklar. Erst seit 2002 ist es möglich, die Zellproliferation durch starke, fokussierte Röntgenstrahlen zu unterbinden und damit aussagekräftige Experimente durchzuführen. Die Ergebnisse dieser Studien sind jedoch bislang uneinheitlich; so geschädigte Tiere zeigen Defizite (aber keinen vollständigen Ausfall) in einigen, aber nicht allen räumlichen Lernparadigmata. Andererseits wurde bei Jugendlichen, die aufgrund eines Hirntumors mit Röntgenstrahlung behandelt wurden, eine fortschreitende und unheilbare anterograde Amnesie beobachtet. Simulationsstudien mit künstlichen neuronalen Netzen deuten auf unterschiedliche mögliche Funktionen der Neurogenese hin: Stabilisierung des Hippocampus gegen äußere Einflüsse, Vermeidung katastrophaler Interferenz, leichteres Vergessen früher gelernter Muster. Zu beachten ist dabei, dass eine neu entstandene Zelle sich erst im Laufe von etwa vier Wochen zum Neuron differenziert, also lange nach dem Ereignis, welches die Teilung angeregt hatte. Es wurde gezeigt, dass neue Neuronen in der Zeitspanne von vier bis 28 Tagen nach Teilung die Lernfähigkeit beeinflussen.
Siehe auch
Literatur
- Christine N. Smith, Larry R. Squire: Medial Temporal Lobe Activity during Retrieval of Semantic Memory Is Related to the Age of the Memory. In: J. Neuroscience. Band 29, Nr. 4, 29. Januar 2009, doi:10.1523/JNEUROSCI.4545-08.2009, PMID 19176802, PMC 2670190 (freier Volltext) – (englisch, jneurosci.org [abgerufen am 1. November 2016] Review in Endlager der Erinnerung (Wissenschaft.de, 28. Januar 2009)).
- Waters, Spencer & Basile, Benjamin & Murray, Elisabeth (2023): Reevaluating the role of the hippocampus in memory: A meta-analysis of neurotoxic lesion studies in nonhuman primates. Hippocampus. 10.1002/hipo.23499.
Weblinks
- Gyorgy Buzsaki: Hippocampus. In: Scholarpedia. (englisch, inkl. Literaturangaben)
Einzelnachweise
- Antonio Abellán, Ester Desfilis, Loreta Medina: Combinatorial expression of Lef1, Lhx2, Lhx5, Lhx9, Lmo3, Lmo4, and Prox1 helps to identify comparable subdivisions in the developing hippocampal formation of mouse and chicken. In: Frontiers in Neuroanatomy. Band 8, 2014, doi:10.3389/fnana.2014.00059 (englisch, freier Volltext).
- hippocampus dictionary.com (englisch)
- hippocampus Online Etymology Dictionary (englisch)
- T. Koch, R. Berg: Lehrbuch der Veterinär-Anatomie. 4. Auflage. Band 3. Fischer, Jena 1985, S. 422.
- Kazu Nakazawa et al.: NMDA receptors, place cells and hippocampal spatial memory. In: Nature Reviews Neuroscience. Band 5, 2004, doi:10.1038/nrn1385 (englisch): “Zitat aus Box 1: The relative locations of these place-receptive fields change in different environments, with no apparent topographical relationship to cell position”
- P. Videbech, B. Ravnkilde: Hippocampal volume and depression. In: Am. J. Psychiatry. Band 161, 2004, S. 1957–1966 (englisch).
- J. L. Warner-Schmidt, R. S. Duman: Hippocampal neurogenesis. Opposing effects of stress and antidepressant treatment. In: Hippocampus. Band 16, 2006, S. 239–249 (englisch).
- M. B. Stein et al.: Hippocampal volume in women victimized by childhood sexual abuse. In: Psychol. Med. Band 27, 1997, S. 951–959 (englisch).
- J. D. Bremner: Does stress damage the brain? In: Biol. Psychiatry. Band 45, 1999, S. 797–805, doi:10.1016/s0006-3223(99)00009-8, PMID 10202566 (englisch).
- S. Koelsch et al.: A cardiac signature of emotionality. In: Eur. J. Neurosci. Band 26, 2007, S. 3328–3338 (englisch).
- Stefan Koelsch: Towards a neural basis of music-evoked emotions. In: Trends in Cognitive Sciences. Band 14, 2010, S. 131–137, doi:10.1016/j.tics.2010.01.002 (englisch, sciencedirect.com).
- Taffe et al.: Long-lasting reduction in hippocampal neurogenesis by alcohol consumption in adolescent nonhuman primates. In: PNAS. Band 107, 2010, S. 11104–11109 (englisch).