Herbstmilbe
Die Herbstmilbe oder Erntemilbe (Neotrombicula autumnalis) ist eine von mehreren Arten saugender Laufmilben in der Familie Trombiculidae aus der Unterklasse Milben in der Klasse der Spinnentiere.[1] Das Larven-Stadium lebt ektoparasitisch von Gewebeflüssigkeit und Lymphe und befällt vornehmlich kleinere Säugetiere (Mäuse, Igel, Kaninchen etc.), Haustiere (Hunde, Katzen) und Menschen sowie in geringerem Maße auch Vögel.[2][3]
| Herbstmilbe | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Larve der Herbstmilbe | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Neotrombicula autumnalis | ||||||||||||
| (Shaw, 1790)
vormals Acarus autumnalis bzw. Trombicula autumnalis |
Die Herbstmilbe wird auch oft Herbstgrasmilbe, Heumilbe oder Grasmilbe genannt, sie hat aber nichts mit den Pflanzenmilben zu tun, die an Gräsern saugen. Auch Trivialnamen wie Herbstlaus, Graslaus, Erdlaus oder Pfirsichlaus sind insofern irreführend, als die ausgewachsen achtbeinigen Milben nicht nahe mit Läusen verwandt sind, die zu den Insekten gehören. Die (sechsbeinigen) Larven der Herbstmilbe rufen beim Menschen als Reaktion auf Hautreizungen häufig eine Dermatose hervor, die im Volksmund Erntekrätze, Stachelbeerkrankheit oder Herbstbeiß heißt und im Fachjargon als Trombidiose oder Trombiculose bezeichnet wird.[4]
Verbreitung
Arten der Milbenfamilie Trombiculidae sind weit verbreitet. Weltweit sind andere Arten der Gattung Neotrombicula und Unterarten beschrieben worden. In Europa ist die Forschung an der Verbreitung und Unterscheidung von Unterarten seit den 1960er Jahren kaum weitergeführt worden. In Europa gelten sechs Trombiculiden-Arten als sporadische Parasiten des Menschen. Die häufigste und am meisten verbreitete Art in Mitteleuropa ist die Herbstmilbe Neotrombicula autumnalis.[4]
In Mitteleuropa gab es in den vergangenen Jahrzehnten eine Zunahme an dokumentierten Fällen der Trombidiose.[5]
Die Larven der Herbstmilben treten von Anfang oder Mitte Juli bis Mitte Oktober auf, selten noch Ende Oktober oder Anfang November bis zum ersten Frost.[6] Außerhalb dieses Zeitraumes wurden keine Larven gefangen. Die Anzahl an nachgewiesenen Larven (Abundanz) folgte dabei einer Glockenkurve (Normalverteilung) mit einem kontinuierlichen Anstieg der Abundanzen ab Juli, einem Höhepunkt Anfang/Mitte September und einen kontinuierlichen Auslaufen bis in den Oktober.[5]
Als Befallsflächen werden oft Orte wie Parks, Gärten und Grünflächen in Städten genannt.[7] In Gärten konnten die Larven ebenso häufig wie auf den Rasenflächen auch in Blumenbeeten ohne Bodenbedeckung nachgewiesen werden. Auf kurzgeschorenem Gras, trockenem Boden sowie Waldboden mit feuchtem Laub treten sie kaum auf.[6]
Biologie und Lebenszyklus

Die erwachsenen Laufmilben und die (Deuto-)Nymphen der Trombiculiden leben räuberisch von anderen Kleinstlebewesen und deren Eiern sowie auch von totem organischem Material im Boden.[1] Nur die bis 0,3 mm großen, rot-orangen sechsbeinigen Larven nehmen als Parasiten Zellsekret (verflüssigte epitheliale Hautzellen, Gewebsflüssigkeit und Lymphe) von ihren Wirten auf.[1][8][9]
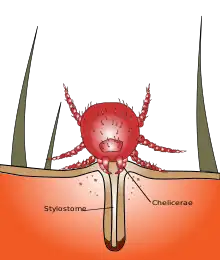

Die Larven haben keine Stechrüssel oder -kanüle wie viele hämatophage Tiere, sondern scherenartige Chelicere, welche die Haut nur anritzen. Sie injizieren gewebezersetzende (histolytische) und gerinnungshemmende (antikoagulierende) Substanzen in die kleine Wunde. Eine weitere Komponente des Speichels sind Mukopolysaccharide, die erhärtend ein Nahrungsrohr (Stylostom) bilden zur Verlängerung und Festigung des Saugkanals mit dem Ziel der Verankerung wie auch der Unterdrückung einer Immunreaktion des Wirtes.[6][10] Am tierischen Wirt kann die Nahrungsaufnahme mehrere Tage dauern. Beim Menschen ist die Saugzeit oft deutlich kürzer (ca. 6–8 Stunden). Durch Cuticulabildung während des Saugens (Neosomie) kann die Larve bis zum 25-fachen ihrer Größe anwachsen. Anschließend fällt sie vom Wirt ab und geht in ein Ruhestadium (Protonymphe; Nymphochrysalis) über. Es entwickelt sich nach wenigen Wochen nach einer Häutung ein achtbeiniges Nymphen-Stadium.
Die Larven krabbeln nach dem Schlüpfen aus dem Ei an die Bodenoberfläche, um ihre natürlichen Wirte (kleinere Säugetiere, Vögel) zu befallen.[11][12]
Sie bevorzugen hohe Luftfeuchtigkeit,[1] Temperaturen von 25 bis 30 °C und sind phototrop sowie negativ geotrop, das heißt, die Larven bewegen sich zum Licht und auf vertikalen Flächen entgegen der Schwerkraft nach oben.[13] An Pflanzen scheinen sie jedoch keine weiten Wege nach oben zurückzulegen. Sie wurden in Sträuchern oder hohem Gras nicht nachgewiesen.[14][5] Möglicherweise ist die Kletter-Höhe von der Luftfeuchtigkeit abhängig.[13] Die Larven sind als Parasiten auf einen maßvollen Umgang mit ihren Energie- und Wasservorräten angewiesen, da sie außerhalb des Wirts keine Nahrung aufnehmen. Sie können Wasserverluste des Körpers durch Transpiration nicht ausgleichen und verenden in für sie ungünstiger Umgebung.[5]
Nach einigen Tagen am Wirt lassen sich die vollgesogenen Larven zu Boden fallen und entwickeln sich über drei Nymphenstadien zum Erwachsenen- (Adult-)Stadium mit einer Länge von etwa 2 mm. Zwei der drei Nymphenstadien sind inaktiv (Proto- und Tritonymphe). Im Frühjahr legen weibliche Milben mehrere hundert Eier, oft an sonnenbeschienene Grashalme.[1]
Infektion mit Herbstmilben-Larven und Krankheitsbild (Dermatose)

Der Mensch wird beim Aufenthalt im Freiland bei zufälligem Kontakt befallen. Auf dem Menschen laufen die Milben, bis sie feucht-warme Stellen mit dünner Haut wie Achselhöhlen oder den Genitalbereich erreichen oder durch eng anliegende Kleidungsstücke an der Fortbewegung gehindert werden.[4] Kinder können auch auf der Kopfhaut betroffen sein.[5] Eventuell suchen die Larven Orte auf, die dem Fell der Wirte ähneln: die Behaarung sorgt für eine relativ hohe Luftfeuchtigkeit und Schutz vor mechanischer Beseitigung durch den Wirt.
Bei Tieren sind häufig auch Körperbereiche mit nur dünner Haut betroffen: Augenränder, Ohren etc.
Mit ihren Mundwerkzeugen ritzen die Larven unbemerkt die obere Hautschicht auf und sondern ein Speichelsekret in die Wunde ab, das Enzyme enthält, die das Gewebe auflösen. Vorverdaute Zellen und Lymphe werden aufgesogen.[15]
Die Dermatose, Trombidiose oder Trombiculose genannt, die durch das Verdauungssekret ausgelöst wird, ist unspezifisch und tritt nach einer Verzögerung von teilweise 12 bis 24 Stunden auf,[5] mit rötlichen Papeln, die Mückenstichen oder anderen Stichreaktionen der Haut ähneln. Der Juckreiz, der zusammen mit den Papeln an der Läsionsstelle der Haut auftritt, ist stärker als bei einem Mückenstich und dauert länger an. Die Sichtbarkeit und die Stärke der Symptome sind beim Menschen individuell verschieden; Hautreaktionen können bis zu 14 Tagen bestehen. Ähnlich lange kann der Juckreiz bleiben, der sich jedoch kontinuierlich verringert. Je nach Larvenbefall treten die Papeln in hoher Anzahl auf.
Im Gegensatz zu Zecken konnte für die Herbstmilbe keine Übertragung von Borreliose nachgewiesen werden.[16] In Asien und der pazifischen Region können die Larven Bakterien übertragen, die das Tsutsugamushi-Fieber auslösen.
Larven-Herde und Fangmethodik
Die Milbenlarven an der Bodenoberfläche sind hauptsächlich in Form inselartiger Herde konzentriert.[1][14] Mit der Kachelfangmethode (s. u.) wurde dabei eine Ausdehnung von 0,3–0,5 m² festgestellt. Als Ursache für das ungleichmäßige Auftreten konnte bislang kein Umweltfaktor bestimmt werden, der die Verbreitung der Tiere signifikant beeinflusst.[5] Daher kann auch keine pauschale Bekämpfungsstrategie empfohlen werden. D. h. auch, der Bodenbewuchs ist unerheblich.
Ein Nachweis bzw. Fang der Herbmilbenlarven an der Bodenoberfläche oder im niedrigen Bewuchs ist auf Grund der geringen Größe der Tiere und der Strukturen des Untergrundes problematisch.
Ein relativer, aber nicht absolut quantitativer Nachweis von Herstbmilbenlarven ist mit Hilfe von weißen Keramikkacheln (Kachelfangmethode) möglich, weil die rötlichen Larven auf dem kontrastreichen Untergrund leicht zu erkennen sind. Zudem gelten sie als positiv phototaktisch, laufen also ins Helle.[17] Die Kacheln liegen wegen ihres Eigengewichtes möglichst nah/eng auf dem Boden auf, was für das Überlaufen der Larven von Vorteil ist; zudem sind auch bei Feuchtigkeit einsetzbar.
Die Kacheln werden mit einem Abstand ca. 70 cm voneinander auf den vermeintlich befallenen Flächen ausgelegt. Nach 10–15 Minuten können die Kacheln mit einer einfachen Lupe (5 bis 10-fach) abgesucht und die Larven durch ihr Erscheinungsbild (s. Abb.) identifiziert werden. Die Kacheln vertikal zu halten, führt zu einer Bewegung der Larven nach oben (negativ geotrop). Die Larven können mit einem feuchten Haarpinsel (Tuschpinsel) ggf. aufgenommen und in ein Fanggefäß abgestreift werden.
Auf Grund der nur relativ quantitativen Aussage der Nachweis- bzw. Fangmethode, besteht keine Sicherheit, dass nicht doch Larven in sehr geringer Anzahl an anderen Stellen auftreten.




Bekämpfung der Milben
In der Publikation zur Studie in Nordrhein-Westfalen[5][18] wird ausgeführt, dass vorbeugende bekämpfende Maßnahmen gegen Herbstmilben keinen Erfolg versprechen bzw. erhebliche Kosten und Aufwand verursachen oder lediglich eine vorübergehende Wirkung haben. Dort sind auch Literaturergebnisse zur Verwendung von Akariziden (Milbengiften) erwähnt: Nach Anwendung verringerte sich die Anzahl der Larven nur über einen Zeitraum von ein bis zwei Wochen, da diese kontinuierlich aus dem Boden nachwandern. Die Gifte können nur dann ausreichend gezielt eingesetzt werden, wenn die Lage der Milbenherde bekannt wäre (s. Larven-Herde und Fangmethodik). Wegen der hohen Kosten und der bedenklichen der Langzeit- und Nebenwirkungen der Gifte sind andere vorbeugende Maßnahmen vorzuziehen.
Durch Bekämpfungsmaßnahmen frei gewordene Bereiche werden in Freianlagen sogleich neu besiedelt: Kontinuierlich wandern Kleinsäuger durch das Gebiet und tragen die Larven an sich. Hausmäuse wandern immer wieder nach und lassen sich nicht langfristig bekämpfen.
Gleiches gilt für eine ökologische Schädlingsbekämpfung mit Niem- oder Zedernöl oder Nutzorganismen, die aktuell bekannt sind. Denn zumeist funktioniert die ökologische Schädlingsbekämpfung nur in geschlossenen Systemen wie in Gewächshäusern. Zumeist fehlen auch Labor- oder Freilandstudien, die die Wirkung belegen. Die Zucht von Herbstmilben im Labor ist selbst in der mehrjährigen Studie nicht gelungen.[16][5]
Die natürlichen Feinde der Herbstmilben und ihrer Eier sind ebenfalls Milben, nämlich Raubmilben. Diese würden einer unspezifischen Bekämpfung ebenfalls zum Opfer fallen.
Die adulten Herbstmilben im Boden zu bekämpfen, erscheint nach dem ökologischen Verbreitungspotenzial und den Umweltgegebenheiten als aussichtslos[5]:
Reichliches Wässern oder die Beseitigung des Bodenbewuchses haben keine Wirkung. Bodenorganismen sind auf die plötzliche Exposition gegenüber Wasser, Licht und Temperaturen eingestellt, da sie diese nach Starkregen-Ereignissen oder der Schnee-Schmelze regelmäßig erfahren. Der Bodenbewuchs ist unerheblich.
Denkbar ist eine Behandlung umgrenzter Milbenherde (z. B. innerhalb von Stechrahmen) mit kochendem Wasser, um Temperaturen jenseits der Toleranzgrenze im Boden zu erreichen. Damit würden dann jedoch sämtliche Lebewesen im Bereich abgetötet, auch der Bewuchs. Die Versuche in der Studie zeigten, dass es eine unverhältnismäßig große Wasser- und Energiemenge erfordert, um durch aufgebrachtes Heißwasser im Boden bis in 40 cm Tiefe über 10 bis 20 Minuten eine Temperatur von 60 °C zu erreichen.[5] Zudem müssten die Herde zunächst lokalisiert werden können.
Milbenbissen vorbeugen
Die Herbstmilbenlarven werden beim Duschen entfernt, weil sie nicht fest in oder an der Haut anhaften, wie beispielsweise Zecken.[4] Eine gründliche Haarwäsche entfernt die Larven auch von der Kopfhaut oder aus den behaarten Stellen am Körper. Ein Abreiben der Haut mit einem Waschlappen sowie mit dem Handtuch zum Abtrocknen ist ebenfalls hilfreich.
Grundsätzlich werden die Larven auf den Hautbereichen mit geringer Behaarung durch das Reiben oder kräftige Wischen mit der Hand mechanisch beseitigt. Das Abstreifen kann durch das Abtöten der Larven mit Alkohol (Spiritus) an den Händen unterstützt werden, ist aber nicht notwendig.
Sofern die Larven bereits mit dem Injizieren von Verdauungssekret in die Haut begonnen hatten, kann die Reaktion des Körpers trotzdem nach einigen Stunden zu (abgeschwächten) Stichsymptomen und Juckreiz führen. Daher sollte mit dem Duschen oder zumindest Abreiben nach dem Aufenthalt auf potenziellen Befallsflächen nicht zu lange gewartet werden.
Weitere Möglichkeiten des Selbstschutzes hängen von den Tätigkeiten bzw. Bewegungen auf den (mutmaßlich) befallenen Flächen ab:
- Die Bekleidung sollte nach dem Aufenthalt auf potenziell befallenen Flächen gewechselt werden.
- Bei Gartenarbeiten sind Gummistiefel, deren Schäfte mit einem beidseitig-klebenden Klebeband einmal rundherum abgeklebt wurden, ein sicherer Schutz.
- Die Herbstmilbenlarven krabbeln am Stiefel hoch, können jedoch die nach außen weisende Klebefläche des Klebeband nicht überwinden. Alternativ können die Hosenbeine in die Socken gesteckt und eventuell mehrere Paar Socken übereinander gezogen werden.[6]
- Auch auf Handschuhe, Handgelenke oder Unterarme kann das doppelseitige Klebeband geklebt werden. Dann sind auch Arbeiten mit den Händen gefahrlos möglich.
- Es ist sinnvoll, zwischendurch gelegentlich die Hände und anschließend auch die Arme kräftig abzureiben. In der Studie zeigte diese Methode eine gute Wirkung beim Zählen der Larven auf den weißen Kacheln.
- Wenn Gartenarbeit auf den Knien verrichtet wird, sollten lange Hosen getragen werden, die den Weg der Larven so verlängern, dass etwas Zeit gewonnen wird, bis das Abduschen erfolgt.
- Es empfiehlt sich, bei der Gartenarbeit zwei Garnituren Gartenkleidung zu verwenden, die abwechselnd getragen und in trockenen Räumen aufgehängt werden. Versuche ergaben, dass Tiere in der im Keller hängenden Kleidung schon nach 24 Stunden nicht mehr nachweisbar waren.[5] Möglicherweise können die Larven im Haus ihren Wasserverlust durch Transpiration nicht ausgleichen und verenden (s. o. Biologie).
- Ein Sonnenbad auf der Terrasse oder anderen befestigten Flächen ohne Bewuchs ist ungefährlich.
- Die Wahrscheinlichkeit, dass sich auf der Terrasse ein Herbstmilbenherd befindet, ist gering. Ob die Tiere am Gestänge von Liegen oder Ähnlichem empor laufen, ist nicht untersucht worden. Ein Abreiben der Beine nach dem Betreten unversiegelter Flächen kann dennoch sinnvoll sein.
- Nackt spielende Kinder scheinen kaum oder gar nicht gestochen zu werden. Das ist nicht weiter untersucht worden, aber es lässt den Schluss zu, dass die Larven auf der nackten Körperoberfläche keine geeigneten geschützten Stellen (mit Behaarung oder unter Kleidung) finden und beim Spiel der Kinder durch mechanische Einwirkungen getötet oder entfernt werden.
- Untersuchungen zur Wirkung von Mitteln, die Insekten abstoßen (Repellentien), gegenüber Herbstmilben sind derzeit nicht bekannt.
- Eine sofortige Dusche ist in jedem Fall eine verlässliche Schutzmaßnahme. Dabei gilt natürlich: je länger der Aufenthalt auf potenziellen Befallsflächen dauerte, desto größer ist die Wahrscheinlichkeit, dass die Larven begonnen haben, Sekret zu injizieren.
Wahrnehmungsproblematik
Zeitraum des Auftretens von Stichen: Es existieren abweichende Aussagen dazu, wann die Larven der Herbstmilben auftreten sollen. Der konkreten Nachweis von Larven ergaben jedoch eine relativ klar abgegrenzte Herbstmilbenlarven-Saison im Zeitraum von Mitte Juli bis Mitte oder Ende Oktober. Die Stichsymptome auf der Haut und der Juckreiz nach Herbstmilbenlarven-Stichen sind unspezifisch. Daher sollten außerhalb des genannten Zeitraumes andere Ursachen für die Symptome angenommen werden. Schöler[5] nennt in Kapitel 4.4.6 (S. 219) weitere mögliche Ursachen für Trombidiose-ähnliche Stichsymptome.
Lokalisation und Art der befallenen Stellen: Oftmals sind die Befallsbereiche (Larven-Herde) an denen man sich Stiche zugezogen hat, wegen des um 12 bis 24 Stunden verzögerten Auftretens der Stichsymptome nicht mehr genau zuzuordnen. Ein Nachweis könnte mit der Kachelfangmethode ausgeführt werden.
Die umgangssprachliche Bezeichnung „Herbstgrasmilbe“ bezieht sich auf die Bodenbedeckung der Befallsstellen. Die Studie zeigt jedoch, dass Bewuchs und Bedeckung des Bodens unerheblich sind. Die Bezeichnung „Erntemilbe“ ergibt sich aus der Übereinstimmung der Zeiträume der während der Erntezeit vermehrt im Freien arbeitenden Menschen und der Zeit der höchsten Larven-Abundanzen, Mitte September.
Vermengung mit der Biologie anderer Milbenarten: Die Bezeichnung „Grasmilbe“, die für die Herbstmilbe sehr verbreitet ist, wird auch für die ebenfalls rot gefärbte Spinnenmilbenart (Bryobia gramineum) verwendet. Diese ist eine für den Menschen harmlose an Pflanzen saugende Milbe. Im Gegensatz zu anderen Spinnenmilben-Arten wandern Herbstmilben nicht an der Hauswand hoch und dringen nicht von sich aus in die Wohnung ein. Ebenso halten sich Herbstmilben nicht in Obststräuchern und -bäumen auf.
Weblinks
Literatur
- Zeitschrift für Allgemeinmedizin: Trombiculiden und Trombidiose (2000) (PDF-Datei; 103 kB)
- A. Schöler: Untersuchungen zur Biologie und Ökologie der Herbstmilbe. Dissertation Universität Bonn 2003 (PDF-Datei; 3,60 MB)
Quellen
- Forschung und zusätzliche Infos, Abschnitt Herbstgrasmilben, AG Parasitologie & Infektionsbiologie, Universität Koblenz. In: uni-koblenz.de
- Volker Storch, Ulrich Welsch: Systematische Zoologie. 5. Auflage. Fischer, Stuttgart 1996, ISBN 3-437-25160-0, S. 288.
- I. Literák, M. Honza, B. Pinowska, A. Haman: Larvae of Trombiculid Mites (Acarina: Trombiculidae) in Wild Birds in the Slovak and Polish Carpathians. In: Acta Veterinaria Brno. Band 70, Nr. 4, 2001, ISSN 0001-7213, S. 479–483, doi:10.2754/avb200170040479 (vfu.cz [abgerufen am 16. September 2022]).
- Helge Kampen: Trombiculiden und Trombidiose. In: Zeitschrift für Allgemeinmedizin. Band 76. Hippokrates Verlag GmbH, Stuttgart 2000, S. 392–396.
- Arne Schöler: Untersuchungen zur Biologie und Ökologie der Herbstmilbe Neotrombicula autumnalis (Acari: Trombiculidae) im Hinblick auf Bekämpfungsmöglichkeiten sowie zu ihrer Bedeutung als Vektor der Borreliose. 2003 (uni-bonn.de [abgerufen am 15. September 2022] Universitäts- und Landesbibliothek Bonn).
- Steve Tally: As chiggers get thicker it's no time to snicker, entomologist says. Purdue University, 16. Juli 2001, abgerufen am 2. Juli 2019 (englisch).
- An anderen Orten halten sich deutlich weniger Menschen auf, so dass dort weniger Dermatosen dokumentiert werden, ohne dass hierdurch jedoch auf eine geringere Larven-Abundanz geschlossen werden könnte.
- R.P. Lane, R.W. Crosskey (Hrsg.): Medical insects and arachnids. 1. Auflage. Chapman & Hall, London 1993, S. 644–658.
- Informationsblatt Herbstmilben (pdf) des Landesgesundheitsamtes Baden-Württemberg, November 2010.
- Kevin Ambrose: Gross: The insanely itchy chigger feasts as summer retreats In: The Washington Post, 14. September 2014. Abgerufen am 2. Juli 2019 (englisch).
- Mites (Acari). In: Veterinary Ectoparasites: Biology, Pathology and Control. Blackwell Science Ltd, Oxford, UK 2001, ISBN 978-0-470-69050-5, S. 23–54, doi:10.1002/9780470690505.ch2 (wiley.com [abgerufen am 16. September 2022]).
- Richard Wall & David Shearer: Veterinary Ectoparasites: Biology, Pathology, and Control. 2. Auflage. John Wiley and Sons, 2001, ISBN 978-0-632-05618-7, Trombiculidae, S. 47–48 (englisch, google.co.uk).
- B. M. Jones: The Sensory Physiology of the Harvest Mite Trombicula Autumnalis Shaw. In: Journal of Experimental Biology. Band 27, Nr. 3, 1. Dezember 1950, ISSN 1477-9145, S. 461–494, doi:10.1242/jeb.27.3.461 (biologists.com [abgerufen am 17. September 2022]).
- A.F.M. Garben, T. Van Ebbenhorst Tengbergen, J.E.M.H. Van Bronswijk: Distribution and Dispersal of the Chigger Neotrombicula Autumnalis (Shaw, 1790) (Trombiculidae, Acari). Part I. the Behaviour of the Unfed and Feeding Larva. In: Netherlands Journal of Zoology. Band 28, Nr. 2, 1977, ISSN 0028-2960, S. 193–205, doi:10.1163/002829678X00044 (brill.com [abgerufen am 16. September 2022]).
- B. M. Jones: The Penetration of the host tissue by the harvest mite, Trombicula Autumnalis shaw. In: Parasitology. Band 40, Nr. 3-4, Oktober 1950, ISSN 0031-1820, S. 247–260, doi:10.1017/S0031182000018096 (cambridge.org [abgerufen am 17. September 2022]).
- H. Kampen, A. Schöler, M. Metzen, R. Oehme, K. Hartelt: Neotrombicula autumnalis (Acari, Trombiculidae) as a vector for Borrelia burgdorferi S.L.? In: Experimental and Applied Acarology. Band 33, Nr. 1/2, 2004, ISSN 0168-8162, S. 93–102, doi:10.1023/B:APPA.0000029975.92510.90 (springer.com [abgerufen am 16. September 2022]).
- B. M. Jones: The Sensory Physiology of the Harvest Mite Trombicula Autumnalis Shaw. In: Journal of Experimental Biology. Band 27, Nr. 3, 1. Dezember 1950, ISSN 1477-9145, S. 461–494, doi:10.1242/jeb.27.3.461 (biologists.com [abgerufen am 16. September 2022]).
- Arne Schöler, Walter A. Maier, Helge Kampen: Multiple Environmental Factor Analysis in Habitats of the Harvest Mite Neotrombicula autumnalis (Acari: Trombiculidae) Suggests Extraordinarily High Euryoecious Biology. In: Experimental & Applied Acarology. Band 39, Nr. 1, Mai 2006, ISSN 0168-8162, S. 41–62, doi:10.1007/s10493-006-0025-z (springer.com [abgerufen am 16. September 2022]).