HBsAg
HBsAg (englisch HBV surface antigen ‚HBV-Oberflächenantigen‘) ist ein Oberflächenprotein in der Virushülle des Hepatitis-B-Virus (HBV). Das HBsAg ist zudem der wirksame Bestandteil in den zugelassenen Hepatitis-B-Impfstoffen.
| HBsAg | ||
|---|---|---|
| ||
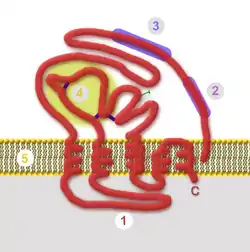
| schematischer Aufbau des HBsAg mit intrazellulärer Domäne (1), T-Zell-Epitop (2), Andockstelle (3), hypervariabler Domäne (4) und Lipiddoppelschicht (5) | ||
| Andere Namen |
| |
| Masse/Länge Primärstruktur | 226 Aminosäuren, 25,4 kDa | |
| Bezeichner | ||
| Externe IDs | ||
Eigenschaften

Das HBsAG ist ein Transmembranprotein mit fünf Membrandurchgängen und drei Disulfidbrücken auf der Membranaußenseite. Gleichzeitig ist es ein Antigen, gegen das während einer Infektion oder nach einer Impfung neutralisierende Antikörper gebildet werden. Es dient dem HBV zum Andocken an Glykosaminoglykane als Rezeptor und dann zur Bindung an NTCP (Na+-taurocholate cotransporting polypeptide) auf einer Wirtszelle.[1][2] Anschließend dient HBsAg als fusogenes Protein zur Freisetzung des HBV ins Zytosol. HBsAg wurde ursprünglich von Baruch Blumberg als Australia-Antigen bezeichnet, da es im Blut eines australischen Aborigines gefunden wurde.[3] HBsAg bildet spontan Virosomen von 20 nm Durchmesser aus, die bei Infizierten eine Konzentration von bis zu 1012 Partikel pro Milliliter Blut erreichen.[4]
Das Auftreten von Anti-HBs-Antikörpern (Serokonversion) gegen HBsAg kennzeichnet den Übergang zur nicht-infektiösen Erkrankung. Weiterhin wird im Zuge der virologischen Diagnostik eine erfolgte Infektion mit HBV durch Bestimmung des Serum-HBsAg oder per Antigen-ELISA nachgewiesen. In der Histotechnik kann HBsAg durch die Orcein-Färbung nach Shikata angefärbt werden.[5] Etwa vierzehn Tage nach einer Impfung mit HBsAg können Antikörper dagegen nachgewiesen werden.[6]
Einer der ersten Impfstoffe gegen HBV (Heptavax) wurde aus dem Blutplasma von HBV-Infizierten gereinigt, aufgrund des Kontaminationsrisikos durch andere Pathogene wurde später auf rekombinantes HBsAg aus der Bäckerhefe umgestellt.
Das Hepatitis-D-Virus benötigt HBsAg, um pathogen zu werden.[7]
Einzelnachweise
- J. M. Wettengel, B. J. Burwitz: Innovative HBV Animal Models Based on the Entry Receptor NTCP. In: Viruses. Band 12, Nummer 8, Juli 2020, S. , doi:10.3390/v12080828, PMID 32751581, PMC 7472226 (freier Volltext).
- H. Yan, G. Zhong, G. Xu, W. He, Z. Jing, Z. Gao, Y. Huang, Y. Qi, B. Peng, H. Wang, L. Fu, M. Song, P. Chen, W. Gao, B. Ren, Y. Sun, T. Cai, X. Feng, J. Sui, W. Li: Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus. In: eLife. Band 1, November 2012, S. e00049, doi:10.7554/eLife.00049, PMID 23150796, PMC 3485615 (freier Volltext).
- Baruch S. Blumberg: A "New" Antigen in Leukemia Sera. In: JAMA 191, 1965, S. 541, doi:10.1001/jama.1965.03080070025007.
- D. M. Knipe, Peter M. Howley (Hrsg.): Fields Virology. 5. Auflage, Philadelphia 2007. ISBN 0-7817-6060-7.
- P. Guarascio, F. Yentis, U. Cevikbas, B. Portmann, R. Williams: Value of copper-associated protein in diagnostic assessment of liver biopsy.. In: Journal of Clinical Pathology. 36, 1983, S. 18, doi:10.1136/jcp.36.1.18.
- Carolyn D Rysgaard, Cory S Morris, Denny Drees, Tami Bebber, Scott R Davis, Jeff Kulhavy, Matthew D Krasowski: Positive hepatitis B surface antigen tests due to recent vaccination: a persistent problem. In: BMC Clinical Pathology. 12, 2012, S. 15, doi:10.1186/1472-6890-12-15.
- N. Chai, H. E. Chang, E. Nicolas, Z. Han, M. Jarnik, J. Taylor: Properties of subviral particles of hepatitis B virus. In: Journal of virology. Band 82, Nummer 16, August 2008, ISSN 1098-5514, S. 7812–7817, doi:10.1128/JVI.00561-08. PMID 18524834, PMC 2519590 (freier Volltext).