Guanylin
Guanylin, auch Guanylatzyklase-Aktivator 2A (GUCA2A) ist, ebenso wie Uroguanylin ein Peptidhormon.
| Guanylin | ||
|---|---|---|
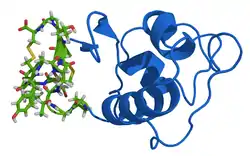
| ||
| Proguanylin mit Guanylin (grün) nach PDB 1O8R | ||
| Masse/Länge Primärstruktur | 15 Aminosäuren | |
| Präkursor | Proguanylin (94 aa; 10,3 kDa) | |
| Bezeichner | ||
| Gen-Name(n) | GUCA2A ; GUCA2; STARA | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 2980 | |
| Ensembl | ENSG00000197273 | ENSMUSG00000023247 |
| UniProt | Q02747 | P33680 |
| Refseq (mRNA) | NM_033553 | NM_008190 |
| Refseq (Protein) | NP_291031 | NP_032216 |
| Genlocus | Chr 1: 42.4 – 42.4 Mb | Chr 4: 119.31 – 119.31 Mb |
| PubMed-Suche | 2980 | |
Entdeckung
Das Guanylin wurde 1992 erstmals entdeckt. Es erhielt diesen Namen aufgrund seiner Eigenschaft einen bestimmten Rezeptor, die Guanylatzyklase-C (GC-C) zu aktivieren.[1] Kurze Zeit später konnte ein weiterer Ligand dieses Rezeptors aus dem Urin von Opossums isoliert werden. Seiner Herkunft entsprechend erhielt es den Namen Uroguanylin.[2]
Struktur
Guanylin
Das humane Guanylin(101-115) besteht aus 15 Aminosäuren in der Abfolge Pro-Gly-Thr-Cys-Glu-Ile-Cys-Ala-Tyr-Ala-Ala-Cys-Thr-Gly-Cys. Es bestehen zwei Disulfidbrücken zwischen Cys4 und Cys12 sowie zwischen Cys7 und Cys15, die für die biologische Aktivität essentiell sind. Die Summenformel lautet C58H87N15O21S4, die Molekülmasse beträgt 1459 Da.[3]
Uroguanylin
Das humane Uroguanylin(96-112) besteht aus 16 Aminosäuren in der Abfolge Asn-Asp-Asp-Cys-Glu-Leu-Cys-Val-Asp-Val-Ala-Cys-Thr-Gly-Cys-Leu. Auch Uroguanylin besitzt die beiden Disulfidbrücken zwischen Cys4 und Cys12 sowie zwischen Cys7 und Cys15. Die Summenformel lautet C64H102N18O26S4, die Molekülmasse beträgt 1668 Da.[3]
Beide Peptidhormone sind dem Enterotoxin (STa) aus Escherichia coli ähnlich. Die Aminosäuren-Sequenzidentität beträgt für das Guanylin 42 %, für das Uroguanylin 57 %.[1][4]
Wirkungsweise
Beide Hormone werden in der gastrointestinalen Schleimhaut (Mukosa) produziert. Durch Bindung an einen intestinalen Rezeptor, die Guanylatzyklase-C (GC-C), sind beide Hormone an der Regulation des Flüssigkeits- und Elektrolythaushaltes sowie der Nährstoffaufnahme im Darm beteiligt. Aufgrund dieser Eigenschaft bezeichnet man sie auch natriuretische Peptide. Mit Hilfe von Kompetitionsexperimenten konnte nachgewiesen werden, dass beide Peptidhormone um die gleiche Bindungsstelle konkurrieren.[1][2] Durch Bindung an eine extrazelluläre Ligandenbindungsstelle dieses Rezeptors wird ein Anstieg des Botenstoffes cGMP (cyclisches Guanosinmonophosphat) in der Zelle ausgelöst. Dies führt zu einer erhöhten Sekretion von Chlorid-Ionen und zur Hemmung der Natriumchlorid-Resorption. Die Folge ist das Ausströmen von Wasser in das Darmlumen.[5][6]
Beide Hormone zeigen eine vom pH-Wert abhängige Aktivität. Das Guanylin ist bei einem alkalischen pH-Wert aktiver, das Uroguanylin dagegen bei einem sauren pH-Bereich. Diese Aktivitätsabhängigkeit vom pH-Wert deckt sich mit dem Expressionsmuster der beiden Enzyme. So ist Guanylin vor allem vom Zwölffingerdarm (Duodenum) bis zum Dickdarm (Kolon) zu finden, Uroguanylin kommt dagegen im gesamten Gastrointestinaltrakt, einschließlich des Magens vor.[2][7] Darüber hinaus gelang der Nachweis von Uroguanylin in der menschlichen Niere.[8][9] Dabei sind Uroguanylin und Guanylin in den distalen Tubuli und Sammelrohren nachweisbar.[9]
Die dreidimensionale Struktur der Peptidhormone[10] wird von den hitzestabilen Enterotoxinen der in der Darmflora des Menschen angesiedelten Bakterienstämme E. coli nachgeahmt. Die Enterotoxine zeigen jedoch eine etwa hundertfach höhere Aktivität als Uroguanylin und Guanylin, was vermutlich an ihrer zusätzlichen, dritten Disulfidbrücke liegt. Aufgrund dieser immens höheren Aktivität verursachen sie einen unnatürlich starken Wasserausstrom in das Darmlumen, was schließlich zu schweren wässrigen Durchfällen führt.[5][6]
Sonstiges
Eine dem Uroguanylin ähnliche Verbindung wird derzeit von einem biopharmazeutischen Unternehmen untersucht. Der Wirkstoffkandidat (Guanilib) soll den Weg zu einer neuen Kategorie von Verbindungen, bezeichnet als Guanylatzyklase-Rezeptor-Antagonisten (GCRA) öffnen und neue Möglichkeiten zur Behandlung von gastrointestinalen Erkrankungen sein.[11]
Einzelnachweise
- M.G. Currie et al.: Guanylin: an endogenous activator of intestinal guanylate cyclase. In: Proc. Natl. Acad. Sci. USA. 89, 1992, S. 947–951.
- F.K. Hamra et al.: Uroguanylin: structure and activity of a second endogenous peptide that stimulates intestinal guanylate cyclase. In: Proc.Natl.Acad.Sci.U.S.A. 90, 1993, S. 10464–10468.
- Chemikalienkatalog Peptanova.
- J: Klodt et al.: Synthesis, biological activity and isomerism of guanylate cyclase C-activating peptides guanylin and uroguanylin. In: J.Pept.Res. 50, 1997, S. 222–230.
- L.R. Forte et al.: Guanylin peptides: cyclic GMP signaling mechanisms. In: Braz.J.Med.Biol.Res. 32, 1999, S. 1329–1336.
- S.H.W. Chu, A. Walker: Bacterial toxin interaction with the developing intestine. In: Gastroenterology. 104, 1993, S. 916–925.
- N.S. Joo et al.: Regulation of intestinal Cl- and HCO3-secretion by uroguanylin. In: Am.J.Physiol. 274, 1998, S. G633–G644.
- S. Fujimoto et al.: Immunhistochemical Localization of Uroguanylin in the human kidney. In: Nephron. 84, 2000, S. 88–89.
- I. Wollenschlaeger et al.: Localization of uroguanylin and guanylin in the human kidney. In: FASEB A579.10. 1999.
- U.C. Marx et al.: One peptide, two topologies: structure and interconversion dynamics of human uroguanylin isomers. In: J Pept Res. 52, 1998, S. 229–240.
- Pressemitteilung Callisto Pharmaceuticals Inc., ISIN US1312EM1041.