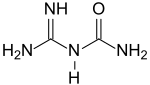
Guanylharnstoff
Guanylharnstoff ist ein Folgeprodukt der Reaktion von Dicyandiamid DCD mit starken Säuren, wie z. B. Schwefelsäure H2SO4 zum Guanylharnstoffsulfat, und entsteht durch anschließende Freisetzung der Base, z. B. mittels Bariumhydroxid.[4] 1-Carbamoylguanidin ist das Hauptabbauprodukt des Antidiabetikums Metformin[5] und Ausgangsstoff für pharmazeutische Wirkstoffe, Pflanzenschutzmittel und Explosivstoffe.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Guanylharnstoff | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H6N4O | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 102,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Guanylharnstoff kommt nicht natürlich vor, findet sich jedoch weit verbreitet in Oberflächengewässern in Konzentrationen bis zu 28 µg/l[6] als Abbauprodukt des gegen Typ-2-Diabetes wirksamen Biguanids Metformin. Der Wirkstoff wird im menschlichen Organismus nicht metabolisiert und zu ca. 90 % unverändert ausgeschieden, aber in Abwasserkläranlagen anaerob zu Guanylharnstoff abgebaut.

In der Ruhr stellte GU im Jahr 2018 mit 3,3 Jahrestonnen nach dem Komplexbildner EDTA das zweithäufigste unter den regelmäßig gemessenen Spurenstoffen dar – allerdings mit seit Jahren abnehmender Tendenz (in 2016: 5,6 to/a).[7] Mit adaptiertem Belebtschlamm kann aber auch Guanylharnstoff vollständig abgebaut werden.[8]
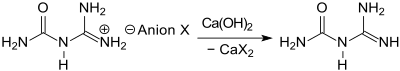
Bei der erstmals 1862 berichteten chemischen Synthese von Guanylharnstoff (hier als Dicyandiamidin bezeichnet)[4] wird Dicyandiamid zu einer verdünnten Mineralsäure, wie z. B. Salpetersäure, Salzsäure oder Schwefelsäure[9] oder einer starken organischen Säure, wie z. B. Ameisensäure[10][11] gegeben, wobei sich beim Erwärmen auf 80 °C Cyanoguanidin DCD löst und in exothermer Reaktion unter Hydrolyse der Cyanogruppe zur Amidgruppe zum Guanylharnstoffsalz der entsprechenden Säure reagiert.

Die gut wasserlöslichen Salze des Guanylharnstoffs fallen beim Abkühlen „in a high stage of purity and very good yields“[9] nur dann an, wenn die Reaktionstemperatur bei ca. 100 °C gehalten und die Wassermenge begrenzt, bzw. gelöstes Salz mit einem wassermischbaren organischen Lösungsmittel wie Aceton ausgefällt wird. Aus der wässrigen Lösung des Guanylharnstoff-sulfats kann die Base Guanylharnstoff durch Zugabe von Bariumhydroxid[2], aus anderen Salzen mittels Calciumhydroxid bei Temperaturen < 50 °C[9] freigesetzt werden.
Eigenschaften
1-Carbamoylguanidin ist ein weißer Feststoff, der in „langen, glasglänzenden Prismen“ kristallisiert und sich in Wasser und Pyridin und in Ethanol in der Wärme gut löst.[2] Wegen ihrer geringeren thermischen Stabilität – die Nitrat- und Perchlorat-Salze sind allerdings bis > 200 °C beständig[12] – und der ausgeprägten Hygroskopie und Adsorption von CO2 aus der Luft wird die Base Guanylharnstoff meist in Form ihrer gut wasserlöslichen Mineralsalze, wie z. B. Nitrat, Chlorid, Phosphat oder Sulfat bzw. ihrer in dipolar aprotischen Lösungsmitteln löslichen organischen Salze, wie z. B. des Formiats verwendet.
Anwendungen
Guanylharnstoffnitrat GUN bildet mit basischem Kupfer(II)-nitrat BCN als Oxidationsmittel einen gaserzeugenden Komplex, der als Ersatz für giftiges Natriumazid als Gasgenerator für Airbags vorgeschlagen wird[13] – ebenso wie so genannte „energiereiche“ Salze des GU mit, z. B. Azid-Anionen.[14]
Das aus Guanidincarboxamid und Ammoniumdinitramid zugängliche Salz Guanylharnstoffdinitramid (GUDN, FOX-12) wird als halogenfreies, „grünes“ Treibmittel für Raketenantriebe und wegen seiner außerordentlich hohen Unempfindlichkeit gegenüber Schlag und Reibung als robuster Explosivstoff untersucht.
5-Azacytosin ist ein 1,3,5-Triazin (sym-Triazin), in dem die 5-CH-Gruppe der Nukleinbase Cytosin durch ein Stickstoffatom ersetzt ist. Es entsteht in ca. 80 %iger Ausbeute bei der Reaktion von Guanylharnstoff[15] bzw. Guanylharnstoff-formiat mit Orthoameisensäuretriethylester HC(OEt)3 in Dimethylformamid DMF bei ca. 100 °C.[16]
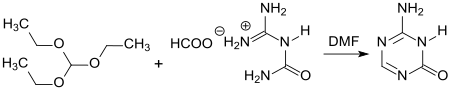
Die Zytostatika Azacitidin (5-Azacytidin) und Decitabin (5-Aza-2‘-deoxycytidin) sind synthetische Nucleoside, die beide 5-Azacytosin als Nukleinbase aufweisen.
Einzelnachweise
- Eintrag zu Guanylurea bei Toronto Research Chemicals, abgerufen am 20. Mai 2020 (PDF).
- J. Söll, A. Stutzer: Mitteilungen über einige neue Verbindungen, die aus Guanylharnstoff und aus Diguanid erhalten werden. In: Ber. dtsch. chem. Ges. Band 42, Nr. 4, 1909, S. 4532–4541, doi:10.1002/cber.19090420453.
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 22 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. Haag: Ueber Dicyandiamid und eine neue daraus entstehende Base. In: Liebigs Ann. Chem. Band 122, Nr. 1, 1862, S. 22–33, doi:10.1002/jlac.1862220103.
- S. Tisler, C. Zwiener: Formation and occurrence of transformation products of metformin in wastewater and surface water. In: Sci. Total Environ. Band 628–629, 2018, S. 1121–1129, doi:10.1016/j.scitotenv.2018.02.105.
- M. Scheurer, A. Michel, H.-J. Brauch, W. Ruck, F. Sacher: Occurrence and fate of the antidiabetic drug metformin and its metabolite guanylurea in the environment and during drinking water treatment. In: Water Res. Band 45, Nr. 15, 2012, S. 4790–4802, doi:10.1016/j.watres.2012.06.019.
- Ruhrgütebericht 2018. Ruhrverband, 2019, S. 86–87, abgerufen am 21. Mai 2020.
- S. Tisler, C. Zwiener: Aerobic and anaerobic formation and biodegradation of guanyl urea and other transformation products of metformin. In: Water Res. Band 45, Nr. 149, 2019, S. 130–135, doi:10.1016/j.watres.2018.11.001.
- Patent US2277823: Preparation of guanyl urea. Angemeldet am 13. Dezember 1939, veröffentlicht am 31. März 1942, Anmelder: American Cyanamid Co., Erfinder: G.H. Foster, D.W. Jayne, Jr..
- Patent CA427499A: Guanyl urea formate production. Veröffentlicht am 15. Mai 1945, Anmelder: American Cyanamid Co., Erfinder: H.M. Day, D.W. Jayne, Jr..
- R.C. Hartenstein, I. Fridovich: Amidinourea formate, a precursor of 2-amino-4-hydroxy-s-triazine. In: J. Org. Chem. Band 32, Nr. 5, 1967, S. 1653–1654, doi:10.1021/jo01280a095.
- Thomas M. Klapötke: The preparation and characterization of guanylurea nitrate and perchlorate salts. In: Heteroatom Chem. Band 19, Nr. 3, 2008, S. 301–306, doi:10.1002/hc.20419.
- Patent EP1335890B1: Gaserzeugung mit Metallkomplexen von Guanylharnstoffnitrat. Angemeldet am 15. November 2001, veröffentlicht am 29. September 2004, Anmelder: Autoliv ASP, Inc., Erfinder: I.V. Mendenhall.
- T.M. Klapötke, C.M. Sabaté: Low energy monopropellants based on the guanylurea cation. In: ZAAC. Band 636, Nr. 1, 2010, S. 163–175, doi:10.1002/zaac.200900330.
- Patent WO2010017374A1: Process for preparing azacitidine intermediate. Angemeldet am 6. August 2009, veröffentlicht am 11. Februar 2010, Anmelder: Sicor Inc., Erfinder: E. Bigatti, G. Lux, M. Paiocchi, A. Giolito, S. Tosi.
- A. Piskalá: Nucleic acid components and their analogues. CI. Synthesis of 5-azacytosine (4-amino-1,2-dihydro-1,3,5-triazin-2-one) and its methyl derivatives. In: Collect. Czech. Chem. Commun. Band 32, Nr. 11, 1967, S. 3966–3976, doi:10.1135/cccc.19673966.
