Glycylglycin
Glycylglycin ist das Dipeptid der Aminosäure Glycin und somit das einfachste Peptid.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
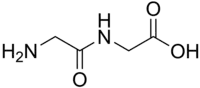 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycylglycin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H8N2O3 | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 132,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser (132 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Glycylglycin wurde erstmals 1901 von Emil Fischer und Ernest Fourneau durch Kochen von 2,5-Diketopiperazin (synonym: Glycinanhydrid) mit Salzsäure hergestellt.[4] Weiterhin entsteht es auch durch Alkalilaugen[3] und viele weitere Verfahren.[5]
Eigenschaften
N-Glycylglycin ist ein brennbares, schwer entzündbares, weißes, geruchloses Pulver, das leicht löslich in Wasser ist. Es zersetzt sich bei Erhitzung über 262–264 °C.[2]
Verwendung
Glycylglycin wird in der Biochemie als Puffer in den pH-Bereichen 2,5–3,8 und 7,5–8,9 verwendet. In wässrigen Lösungen neigt es zur Hydrolyse.[6] Glycylglycin wird als Puffer im Zuge des Zellaufschlusses zur Vermeidung von Einschlusskörperchen bei einer Proteinreinigung eingesetzt.[7] Das Natriumsalz des Glycylglycins wird in Elektrophoresepuffern bei der Kapillarelektrophorese verwendet.[8] Glycylglycin wird als Ausgangsstoff bei der Peptidsynthese eingesetzt.[9]
Glycylglycin wird zudem in der Kosmetik verwendet, um Haaren eine weichere Haptik zu vermitteln.[10]
Einzelnachweise
- Eintrag zu DIPEPTIDE-15 in der CosIng-Datenbank der EU-Kommission, abgerufen am 29. Dezember 2019.
- Eintrag zu N-Glycylglycin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. November 2022. (JavaScript erforderlich)
- Victor von Richter, Translated and revised by Percy E. Spielman after Edgar F. Smith: Richter's organic chemistry. Hrsg.: R. Anschütz and G. Shroeter. 3rd American Auflage. I. Chemistry of the aliphatic series. P. Blakiston's Son & Co., Philadelphia 1916, S. 391 (google.com [abgerufen am 15. Juli 2010]).
- R.H.A. Plimmer: The chemical composition of the proteins. Hrsg.: R.H.A. Plimmer & F.G. Hopkins (= Monographs on biochemistry. Band II). 1. Auflage. 2008, ISBN 978-1-4097-9725-8 (google.com – Erstausgabe: Longmans, Green and Co., London 1908).
- Max S. Dunn, A. W. Butler, T. Deakers: The synthesis of glycylglycine. In: American Society for Biochemistry and Molecular Biology (Hrsg.): Journal of Biological Chemistry. Band 99, Nr. 1, 1. Dezember 1932, S. 217–220 (jbc.org [PDF]).
- Marshall E. Smith, Lynwood B. Smith: Piperazine Dihydrochloride and Glycylglycine as Non-Toxic Buffers in Distilled Water and in Sea Water. In: Biological Bulletin. 96, 1949, S. 233, doi:10.2307/1538357.
- S Ghosh, S Rasheedi, SS Rahim, S Banerjee, RK Choudhary, P Chakhaiyar, NZ Ehtesham, S Mukhopadhyay, SE Hasnain: Method for enhancing solubility of the expressed recombinant proteins in Escherichia coli. In: BioTechniques. 37. Jahrgang, Nr. 3, 2004, S. 418, 420, 422–3, PMID 15470897.
- A. Zinellu, S. Sotgia, S. Caddeo, L. Deiana, C. Carru: Sodium glycylglycine as effective electrolyte run buffer for ascorbic and uric acid separation by CZE: a comparison with two other CE assays. In: Journal of Separation Science. Band 28, Nummer 16, November 2005, S. 2193–2199, PMID 16318217.
- Susan Budavari (Hrsg.): The Merck Manual. 11th Auflage. Merck & Co., Rahway, NJ 1989, ISBN 0-911910-28-X, S. 707–708.
- S. Breakspear, M. Fukuhara, T. Itou, Y. Hirano, M. Nojiri, A. Kiyomine, S. Inoue: Alignment control and softness creation in hair with glycylglycine. In: Journal of Cosmetic Science. Band 64, Nummer 1, 2013, S. 19–33, PMID 23449128.