Glutethimid
Glutethimid ist ein Arzneistoff, der als Sedativum und Hypnotikum verwendet wurde. Es wurde 1954 von Ciba patentiert und war in Deutschland unter dem Handelsnamen Doriden® auf dem Markt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
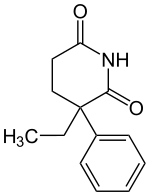 | ||||||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Glutethimid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H15NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05CE01 | |||||||||||||||||||||
| Wirkstoffklasse |
Sedativum, Hypnotikum | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 217,26 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
9,2[1] | |||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (999 mg·L−1 bei 30 °C);[1] leicht löslich in Ethylacetat, Aceton und Diethylether; löslich in Methanol[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Chemisch gesehen gehört es – wie auch Methyprylon, Pyrithyldion und Thalidomid – zur Gruppe der Piperidindione. Diese wiederum sind strukturelle Abwandlungen der Barbiturate.
Wirkmechanismus
Die Wirkungsdauer von Glutethimid entspricht der von mittellang wirksamen Barbituraten. Seine Eliminationshalbwertszeit beträgt 5–22 h. Es hat gegenüber Barbituraten keine Vorteile.
Unerwünschte Wirkungen
Eine Intoxikation mit Glutethimid äußert sich ähnlich wie eine Intoxikation mit Barbituraten. Eine längerfristige Anwendung kann zur Abhängigkeit führen.
Synthese
Glutethimid kann ausgehend aus Benzylcyanid synthetisiert werden. Dieses wird mit Natriumamid deprotoniert und mit Ethylbromid alkyliert. Das so erhaltene 2-Phenylbutansäurenitril wird dann einer Michael-Addition an Acrylsäurenitril unterworfen, das erhaltene 2-Ethyl-2-phenyl-1,5-pentandisäuredinitril wird sodann in Eisessig unter Schwefelsäurewirkung zu Glutethimid zyklokondensiert.[4] Das Zwischenprodukt 2-Phenylbutansäurenitril kann auch mit Methylacrylat umgesetzt werden. Der resultierende 4-Cyano-4-ethyl-4-phenylpentansäuremethylester kann dann analog mittels Eisessig und Schwefelsäure zur Zielverbindung zyklisiert werden. Während der gesamten Synthesesequenz wird mit racemischen Edukten und Zwischenverbindungen gearbeitet. Glutethimid fällt somit bei den Synthesevarianten als Racemat an.[5]

Rechtsstatus
Glutethimid ist in der Anlage II des deutschen Betäubungsmittelgesetzes gelistet und zählt somit zu den verkehrsfähigen, aber nicht verschreibungsfähigen Betäubungsmitteln.
Literatur
- H. P. T. Ammon (Hrsg.): Hunnius Pharmazeutisches Wörterbuch. 9. Auflage. Walter de Gruyter, Berlin / New York 2004, ISBN 3-11-017487-1, S. 662.
- Eintrag zu Glutethimid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
- H. J. Roth, H. Fenner: Arzneistoffe. Thieme, Stuttgart / New York 1988, ISBN 3-13-673501-3, S. 270–271.
Einzelnachweise
- Eintrag zu Glutethimide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station, NJ, USA, 2006, ISBN 0-911910-00-X.
- Datenblatt Glutethimide bei Sigma-Aldrich, abgerufen am 3. April 2011 (PDF).
- F. Hampl, J. Paleček: Farmakochemie. VŠCHT, Praha 2002, ISBN 80-7080-495-5, S. 116. (tschechisch).
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2001, ISBN 1-58890-031-2.