Giraffenartige
Die Giraffenartigen (Giraffidae) sind eine Familie der Paarhufer, die zwei Gattungen umfasst, die Giraffen und das Okapi. Sie stellen nahe Verwandte der Hirsche und Hornträger dar. Im äußeren Erscheinungsbild unterscheiden sich die beiden Vertreter recht deutlich; gemeinsame verbindende Merkmale finden sich neben einem speziell ausgeprägten Eckzahn unter anderem in der Ausbildung von mit Haut überzogenen Hornzapfen als Stirnwaffen. Die Familie wurde im Jahr 1821 von John Edward Gray eingeführt, enthielt ursprünglich aber nur die Giraffen. Erst mit der Entdeckung des Okapis im Jahr 1901 kam ein weiterer Vertreter hinzu. Die Giraffen bestehen nach genetischen Untersuchungen heute aus drei oder vier Arten in bis zu zehn eigenständigen Populationen, das Okapi ist dagegen mit nur einer Art vertreten.
| Giraffenartige | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
._Okapi.jpg.webp)
Okapi (Okapia johnstoni) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Giraffidae | ||||||||||||
| Gray, 1821 |
Die Giraffenartigen sind endemisch in Afrika verbreitet. Während das Okapi die tropischen Regenwälder im zentralen Teil des Kontinents bewohnt, kommen die Giraffen in den offenen Savannenlandschaften des westlichen, östlichen und südlichen Teils vor. Die beiden Gattungen besetzen demzufolge unterschiedliche Biotope, ihre jeweilige Sozialstruktur ist an diese angepasst. Das Okapi stellt einen überwiegenden Einzelgänger dar, die Giraffen leben in lockeren, wenig strukturierten Herdenverbänden. Die Ernährung basiert vor allem auf weicher Pflanzenkost, wobei die Giraffen stark mit Akazien assoziiert sind. Die Giraffenartigen gehören zu den wenigen Paarhufern mit einer Tragzeit von über einem Jahr. In der Regel kommt ein einzelnes Jungtier zur Welt.
Fossil sind die Giraffenartigen seit wenigstens dem Unteren Miozän bekannt. Die Familie ist aus stammesgeschichtlicher Sicht sehr divers, ein größerer Teil ihrer Entwicklung vollzog sich außerhalb Afrikas im südlichen Europa sowie vom westlichen bis zum östlichen Asien. Die frühesten Formen besaßen eine eher hirschartige Gestalt. Aus ihnen entstanden verschiedene Entwicklungslinien. Bei einigen dieser Linien ist eine Verlängerung des Halses nachvollziehbar, wodurch sie wohl in einer direkten Vorgängerschaft zu den heutigen Giraffen stehen. Darüber hinaus schließen die Giraffenartigen auch heute erloschene Gruppen mit voluminösem Körper und kurzen Hälsen ein; die bedeutendste stellen hier die Sivatheriinae dar.
Merkmale
Habitus
.jpg.webp)
Die Giraffenartigen sind allesamt große Vertreter der Paarhufer und schließen die höchsten landbewohnenden Säugetiere ein. Das kleinere Okapi (Okapia) besitzt eine Kopf-Rumpf-Länge von 200 bis 210 cm zuzüglich eines 30 bis 42 cm langen Schwanzes. Die Höhe bis zum Scheitel beträgt etwa 180 cm, das Körpergewicht liegt bei durchschnittlich 270 kg, wobei weibliche Tiere deutlich schwerer sind als männliche. Bei den wesentlich größeren Giraffen (Giraffa) kann die Kopf-Rumpf-Länge 350 bis 450 cm umfassen und der Schwanz 60 bis 110 cm lang werden. Die Tiere sind bis zum Scheitel 450 bis 600 cm hoch, bis zur Schulter messen sie etwa 310 cm. Das Gewicht variiert von 450 bis 1930 kg, wobei Bullen markant schwerer sind als Kühe. Die beiden Gattungen der Giraffenartigen unterscheiden sich etwas im Körperbau, gemeinsam sind ihnen Verlängerungen im Hals- und Beinbereich, die beim Okapi weniger stark ausfallen als bei den Giraffen. Während die Giraffen aufgrund ihres extrem langen Halses und ihrer ebensolchen Beine ein eigenständiges und unverwechselbares Äußeres aufweisen, ähnelt das Okapi im Erscheinungsbild eher einer großen Antilope. Die enormen Halsverlängerungen setzen bei den Giraffen erst nach der Geburt ein.[1] Sie gehen einher mit der Streckung der sieben Halswirbel, einschließlich des hintersten, so dass die Verbindung der Hals- zur Brustwirbelsäule weiter nach hinten versetzt ist als bei anderen Huftieren sonst üblich. Im normalen Lauf halten die Giraffen Hals und Kopf eher aufrecht, nur beim schnellen Rennen und beim Ersteigen von Berghängen werden beide vorgestreckt. Im Unterschied dazu besitzt das Okapi eine eher typisch huftierartig vorgestreckte Kopfhaltung. Beiden Gattungen gemeinsam sind hornartige, mit Haut und Fell überzogene Knochenzapfen, die sich oberhalb des Hirnschädels erheben. Beim Okapi ist ein Paar dieser Hörner ausgebildet, das zumeist nur bei Bullen auftritt und dessen Spitzen manchmal frei von Haut sind. Bei den Giraffen tragen beide Geschlechter ein paariges Horn auf dem Kopf, selten ist noch ein hinteres Hornpaar im Nacken vorhanden.[2] Allerdings haben männliche Tiere häufig noch ein weiteres, meist kleineres Horn, das mittig zwischen den Augen wächst und als sekundäres Geschlechtsmerkmal gilt, mitunter aber auch bei Kühen auftreten kann.[3][2] Auffallend erscheint auch die lange dunkle Zunge, die sehr beweglich ist und zum Greifen befähigt. Das Fell ist kurz mit durchschnittlichen Haarlängen von 9,5 mm. Es treten charakteristische Fellzeichnungen auf, die bei den Giraffen aus einem dunklen Flecken- oder Mosaikmuster vor hellem Grund bestehen. Das generell dunklere, braun gefärbte Okapi zeigt helle Horizontalstreifen an den Beinen. In beiden Fällen kann die Fellzeichnung mit einer defensiven Funktion in Verbindung gebracht werden.[4] Im gesamten äußeren Erscheinungsbild erweist sich das Okapi als typischer Waldbewohner, während die Giraffen Offenlandformen repräsentieren.[5][6]
Hörner
Ein besonderes Kennzeichen der Giraffenartigen sind hornartige Auswüchse auf dem Kopf, auch Hornzapfen oder Ossikone genannt. Das Hornpaar erhebt sich dabei bei den Giraffen auf der Sutur zwischen dem Stirn- und dem Scheitelbein, das vordere Einzelhorn auf dem Stirn- und Nasenbein. Bei den Okapis dagegen sitzt das Hornpaar auf dem Stirnbein. Im Vergleich zu ähnlichen Bildungen bei anderen Stirnwaffenträgern werden die Hörner aber nicht besonders groß, sie erreichen bei Giraffen eine Länge von bis zu 19 cm bei einem Umfang von 22 cm,[2] beim Okapi sind sie immerhin noch 15 cm lang. Sie haben eine etwa konische Form mit abgerundeter Spitze und sitzen auf einer Hornbasis, die die Struktur mit dem Schädel verbindet. Die Hornbasen sind homolog zu entsprechenden Bildungen bei den Hornträgern (Bovidae) oder Gabelhornträgern (Antilocapridae). Sie enthalten luftgefüllte Knochenkammern, die teilweise bis in die Hörner hineinreichen. Die Hörner selbst haben im Innern eine feste, fast elfenbeinartige Struktur. Im Unterschied zu den Hörnern der Hornträger besitzen die der Giraffen keinen Keratinüberzug, sie stellen wie bei diesen aber permanente Bildungen dar, die – abweichend zu den Geweihen der Hirsche (Cervidae) – nicht jährlich abgeworfen werden. Ebenfalls abweichend von anderen gehörnten Paarhufern entwickeln sich die Hörner bereits im Embryonalstadium. Sie sind anfänglich noch nicht mit dem Schädel verbunden und bestehen aus kugelförmigem Knorpelgewebe, das in der Haut eingebettet ist. Erst im Lauf der Individualentwicklung verknöchert das Horn von der Spitze her und dehnt sich weiter aus, bis es etwa im Alter von vier (Männchen) bis sieben (Weibchen) Jahren mit dem Schädel verwächst, was allerdings beim vorderen Horn später geschieht als beim Hornpaar. Nach dem Verwachsen der Hörner mit der Hornbasis findet nur noch ein geringes Längenwachstum durch Knochenumlagerung statt (sekundäres Knochenwachstum). Diese umgelagerte Knochensubstanz, die dem Horn ein weiteres Wachstum von maximal 2 cm beschert, überdeckt die ursprüngliche Hornstruktur und begräbt zudem die Blutgefäße innerhalb des Horns. Prinzipiell haben das Hornpaar und das vordere Einzelhorn der Giraffen einen ähnlichen Aufbau, letzteres ist aber teilweise nicht so deutlich ausgeprägt.[2] Das Hornpaar wird teilweise zur Abtrennung von ähnlichen Bildungen bei anderen Stirnwaffenträgern als Vellericorni (von lateinisch vellus für „Wolle“ und cornu für „Horn“) bezeichnet,[7] für das vordere Einzelhorn als singuläre Bildung innerhalb der Stirnwaffenträger wurde der Fachname Giraffacone („Giraffakon“, so viel wie „Giraffenzapfen“) vorgeschlagen,[8] was allerdings nicht allgemein anerkannt ist.[9] Wie bei den anderen Stirnwaffenträgern wird das Wachstum der Hornzapfen durch Gene gesteuert, die auch für die Bildung von Knochen, Haut und Nerven verantwortlich sind.[10]
Schädel- und Gebissmerkmale


Der Schädel ist im Vergleich zu anderen Huftieren auffallend groß und kann bei Giraffen bis zu 73 cm lang werden. Allerdings ist der Sexualdimorphismus stark ausgeprägt, so dass der Schädel männlicher Tiere bis zu 12 kg wiegen kann, bei weiblichen liegt der Wert bei nur einem Drittel davon.[11][8] Beim Okapi wird der Schädel etwa 46 bis 52 cm lang.[12][7] Markant sind die ausgedehnten luftgefüllten Kammern in der Schädeldecke, die vor allem in der Augenregion des Stirnbeins und angrenzend auch im Nasenbein und im Scheitelbein auftreten. Die Kammern vergrößern das Schädelvolumen, ohne gleichzeitig das Gewicht signifikant zu erhöhen. Der Unterkiefer ist langschmal. Das Gebiss setzt sich aus 32 Zähnen zusammen und besitzt folgende Zahnformel: . Demzufolge fehlen analog zu anderen Stirnwaffenträgern im oberen Gebiss die vorderen Zähne. Im Unterkiefer ragen die Schneidezähne schräg nach vorn, sie sind spatelförmig und formen eine kreissegmentartige Reihe. Der untere Eckzahn ist bei ausgewachsenen Individuen verbreitert und eingekerbt, so dass zwei oder drei Spitzen entstehen, was die Giraffenartigen von anderen Paarhufern unterscheidet. Die Spitzen vermögen Blätter und Zweige zu zerkleinern. Die Molaren haben eine quadratische Form, die Zahnkronen sind niedrig (brachyodont) und die Kaufläche besitzt ein selenodontes Muster, das heißt die Zahnschmelzleisten bilden mondsichelförmige Rippeln entlang der Zahnlängskante.[7][5]
Skelettmerkmale

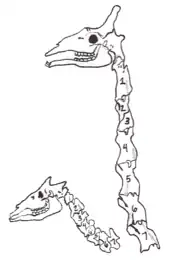
Zu den auffallendsten Merkmalen der Giraffenartigen gehört der lange Hals der Giraffen, dessen knöcherner Unterbau etwa die Hälfte der Länge der gesamten Wirbelsäule erreicht.[13] Typischerweise besteht die Halswirbelsäule bei Säugetieren aus sieben Wirbeln, auffallend bei Giraffen ist der homogene Aufbau der einzelnen Halswirbel gegenüber dem variableren Aufbau beim Okapi. Die einzelnen Wirbel sind bei den Giraffen stark gestreckt, sie besitzen Längen von 17 bis 35 cm, wobei das Maximum in der Mitte des Halses erreicht wird (beim Okapi sind die Halswirbel im Vergleich zwischen 9 und 13 cm lang).[14] Zusätzlich ist bei den Giraffen der erste Brustwirbel markant verlängert und mit einem nur kurzen Dornfortsatz versehen, wodurch er so stärker den Halswirbeln ähnelt. Er besitzt aber säugetiertypisch den ersten Rippenansatz. Der eigentliche Übergang von der Hals- zur Brustwirbelsäule ist demzufolge auf den zweiten Brustwirbel verschoben. Bisweilen wird daher argumentiert, dass der Hals der Giraffen funktional aus acht Wirbeln besteht. Das Merkmal ist charakteristisch für Giraffen und kommt beim Okapi oder einigen anderen ausgestorbenen Vertretern der Giraffenartigen wie Sivatherium nicht vor. Möglicherweise dient dies der höheren Mobilität des Halses der Giraffen.[15][16][17] Stammesgeschichtlich setzte die Streckung der Halswirbelsäule bereits sehr früh ein. Erste Formen mit verlängertem Hals sind bereits im Mittleren Miozän vor rund 14 Millionen Jahren mit Giraffokeryx nachgewiesen. Intermediäre Formen zur heutigen Giraffe treten dann im Oberen Miozän auf, etwa mit Samotherium und Bohlinia, ersteres besaß bereits Halswirbellängen von 16 bis 23 cm. Die Streckung der einzelnen Halswirbel erfolgte nicht gleichmäßig und vollzog sich zuerst im vorderen Teil des Wirbels, erst später verlängerte sich auch der hintere Teil und mündete schließlich in die heute bekannte Wirbelstruktur der Giraffen. Demgegenüber gab es auch einige fossile Vertreter, bei denen sich im Laufe der Entwicklung die Wirbel verkürzten, beispielsweise bei den riesigen Sivatheriinae. Die Verlängerung des Halses bei den Giraffen ging einher mit der Reduktion der Größe der Hörner und der entsprechenden Halsmuskulatur zum Tragen derartiger Stirnwaffen.[4][18][19]
Wie bei allen Paarhufern läuft die Mittelachse der Hand und des Fußes durch die Strahlen III und IV. Im Bereich der Metapodien sind die beiden Strahlen bei den Giraffenartigen miteinander verwachsen und bilden das Kanonenbein. Dieses ist extrem lang sowie schlank, es kann bei den Giraffen bis zu 75 cm Länge erreichen, beim Okapi bis zu 33 cm. Die seitlich ansetzenden Strahlen sind stark zurückgebildet und funktionslos, wobei der innere (Strahl II) häufiger vorkommt als der äußere (Strahl V). Im Gegensatz zu den Hornträgern und den Hirschen haben sich die anschließenden Phalangen (Finger- und Zehenglieder) vollständig zurückentwickelt.[20][21]
Verbreitung
Die Giraffenartigen sind heute auf Afrika beschränkt, kamen aber in der geologischen Vergangenheit über weite Bereiche von Eurasien vor. Gegenwärtig bewohnen sie die Bereiche südlich der Sahara. Die Giraffen haben eine eher fleckenhafte Verbreitung über das westliche, östliche und südliche Afrika. Sie treten in einer Vielzahl verschiedener offener Landschaften auf, die von Gebüsch- bis hin zu Waldsavannen reichen. Charakteristisch ist vor allem ihre Assoziation mit Akaziengewächsen oder laubwerfender Vegetation. Ihre relative Wasserunabhängigkeit befähigt sie auch, in sehr trockenen Landschaften zu überleben. Demgegenüber ist das Okapi auf die tropischen Regenwälder und offenen Wald-Savannen-Mosaiklandschaften des Kongobeckens im zentralen Afrika beschränkt. Es erscheint aber nicht in Galeriewäldern oder sehr sumpfigen Regionen.[5][6]
Lebensweise
Territorial- und Sozialverhalten

Die beiden Vertreter der Giraffenartigen gehören aufgrund ihrer unterschiedlichen Lebensraumansprüche unterschiedlichen ökologischen Typen an. Demzufolge weicht ihre jeweilige Lebensweise deutlich voneinander ab, was auch von anderen Gruppen von Huftieren etwa den Hornträgern und den Hirschen bekannt ist. Das Okapi stellt einen Waldbewohner dar, es ist daher einzelgängerisch und tritt nur selten in Gruppen von bis zu drei Individuen auf. Die Tiere unterhalten einzelne Territorien von 3 bis 13 km² Größe, wobei diese bei Bullen größer sind als bei Kühen. Die Territorien männlicher und weiblicher Tiere überlappen sich, besondere Stellen werden mit einem öligen Sekret der Haut markiert, ebenso defäkieren beziehungsweise urinieren die Tiere an definierten Stellen. Männliche Tiere verteidigen ihr Territorium. Dagegen sind Giraffen in offenen Landschaften anzutreffen, die Tiere bilden hier lockere Herdenverbände bestehend aus Kühen und dem Nachwuchs. Männliche Tiere finden sich in „Junggesellengruppen“ zusammen, darüber hinaus sind auch gemischte Herden bekannt. Insgesamt besitzen die Herden aber keine feste Struktur und bestehen teilweise nur wenige Tage. Demzufolge sind die Tiere auch nicht territorial und verteidigen ihre Aktionsräume nicht. Deren Größe variiert von 25 bis 160 km², in sehr trockenen Gebieten erreichen sie auch bis zu 1950 km². Die Grenzen der Aktionsräume werden häufig durch Flüsse markiert. Im normalen Lauf bewegen sich sowohl die Giraffen als auch das Okapi im Passgang vorwärts, wobei vor allem bei ersteren nach Untersuchungen von Anne Innis Dagg der Hals charakteristisch mitschwingt, was dem Gleichgewicht dient.[22][23][5][6]
Ernährung

Sowohl die Giraffen als auch das Okapi ernähren sich überwiegend von Blättern von zweikeimblättrigen Pflanzen (browsing). Die Tiere fressen stark selektiv und bevorzugen häufig die frischesten Pflanzenteile, die einen hohen Anteil an Proteinen sowie Kalzium- und Phosphat aufweisen, für letztere haben sie aufgrund ihres starken Knochenwachstums einen hohen Bedarf. Das Okapi verspeist dabei mehr als 100 verschiedene Pflanzenarten mit einer Dominanz von etwa 20, die eine große Vielzahl von Pflanzengruppen abdecken, etwa Malvengewächse oder Ebenholzgewächse sowie Vertreter der Putranjivaceae. Das Nahrungsspektrum der Giraffen umfasst bis zu 77 Pflanzenarten, allerdings sind die Giraffen stärker spezialisiert und fressen von diesen weniger als ein Dutzend Arten regelmäßig. Eine besondere Bevorzugung besteht bei Akazien und Langfäden. Zum Abzupfen der Blätter benutzen Giraffen und Okapis ihre lange, bewegliche Zunge. Beide Gattungen sind außerdem an Minerallecken gebunden, vor allem Giraffen kauen teilweise auch an Knochen. Giraffen sind zudem wasserabhängig, sie können aber mehrere Tage ohne Wasser auskommen.[5][6]
Fortpflanzung
Generell ist die Fortpflanzung nicht an bestimmte Jahreszeiten gebunden, sie kann bei Giraffen aber bevorzugt in der Wachstumsphase der Akazien stattfinden. Giraffenbullen führen Werbekämpfe durch, bei denen der lange Hals und der schwere Kopf zum Einsatz kommen; diese Kämpfe können teilweise zu erheblichen Verletzungen führen. Dieses eher ungewöhnliche Kampfverhalten entstand wahrscheinlich mit der Verlängerung des Halses bei den Giraffen.[24] Bei Okapis wurde ein derartiges Verhalten bisher nicht dokumentiert. Die Tragzeit beträgt 14 bis 15 Monate, in der Regel kommt ein Junges zur Welt, selten auch Zwillinge. Giraffenmütter verlassen zur Geburt meist die Herde. Das Kalb ist ein Nestflüchter, verbleibt aber vorerst für mehrere Wochen in einem Versteck. Die Mutter-Jungtier-Beziehung hält etwa 9 bis 14 Monate.[5][6]
Systematik
Äußere Systematik
|
Die Giraffenartigen sind eine Familie aus der Ordnung der Paarhufer (Artiodactyla). Sie gehören innerhalb der Paarhufer wiederum zur Gruppe der Wiederkäuer (Ruminantia), deren Mitglieder über einen mehrkammerigen Magen verfügen. Dieser untergeordnet ist das Taxon der Stirnwaffenträger (Pecora), deren besonderes Merkmal die Ausbildung von Hörnern und Geweihen ist. Dadurch stellen etwa die Hirsche (Cervidae), die Hornträger (Bovidae), die Moschustieren (Moschidae) und die Gabelhornträger (Antilocapridae) die nächsten Verwandten der Giraffenartigen dar. Während morphologische Studien innerhalb der Stirnwaffenträger verschiedenste Verwandtschaftsverhältnisse zeigten und die Giraffenartigen sowohl mit den Gabelhornträgern, den Hornträgern oder mit den Hirschen gruppieren, sprechen molekulargenetische Analysen für eine engere Beziehung zu den Hirschen, Moschustieren und den Hornträgern, wobei die Giraffenartigen dann in einem Schwestergruppenverhältnis zu diesen stehen.[26][27][28] Die weitgehende Aufspaltung der Stirnwaffenträger erfolgte im Übergang vom Oligozän zum Miozän vor rund 24 Millionen Jahren, die Diversifizierung innerhalb der Giraffenartigen setzte dann im Verlauf des Mittleren Miozäns vor rund 15 Millionen Jahren ein.[28][29][25][30] Die unmittelbare nähere Verwandtschaft der Giraffenartigen wie die Climacoceratidae und die Prolibytheriidae werden in der Überfamilie der Giraffoidea zusammengefasst, etwas weiter entfernte Gruppen, etwa die Palaeomerycidae, stehen in den Giraffomorpha.[31]
Innere Systematik
Die heutigen Giraffenartigen setzen sich aus zwei Unterfamilien zusammen. Die eine, die Giraffinae, enthält die Giraffen und definiert sich über die gestreckten Halswirbel, die langen Gliedmaßen mit ebensolchen Metapodien, denen auf der Hinterseite der Mittelhandknochen eine Längsrillung fehlt, sowie über das quadratische Sprungbein und die Hörner, wobei das hintere Paar einen stumpfen Kiel hinten aufweist und zusätzlich noch ein unpaariges vordere Einzelhorn auftritt. Die andere Unterfamilie, die Okapinae, schließt das Okapi ein, bestimmende Merkmale sind die mittellangen Metapodien mit schwacher hinterer Längseindellung der Mittelhandknochen, Hörner mit internen Kanälchen und eine große Paukenblase.[32][6] Andere Systematiken führen beide Gattungen innerhalb der Giraffinae und unterschieden diese auf dem Rang der Tribus.[33]
Daneben bestehen noch mehrere ausgestorbene Unterfamilien. Darunter befindet sich mit den Sivatheriinae oder Rindergiraffen die bekannteste, die relativ formenreich ist und große Tiere mit kräftigem Körperbau und kurzem Hals, großen Stirnhöhlen sowie zwei Paaren an Hörnern einschließt. Sie waren weit über Eurasien und Afrika verbreitet und kamen vom Oberen Miozän bis zum Pleistozän vor. Weitere bedeutende und weitverbreitete Gruppen bilden die Palaeotraginae, Samotheriinae und Bohlininae bestehend aus großen, langgliedrigen Tieren mit einem oder zwei Hornpaaren, die überwiegend im Mittleren und Oberen Miozän in der Alten Welt in Erscheinung traten.[34][32]
Übersicht über die Gattungen und Arten der Giraffenartigen
Folgende Gattungen und Arten werden zu den heutigen Giraffenartigen gestellt:[6][35][36][37]
- Familie: Giraffidae Gray, 1821
- Unterfamilie: Giraffinae Gray, 1821
- Gattung: Giraffa Brisson, 1762
- Nord-Giraffe (Giraffa camelopardalis (Linnaeus, 1758))
- Süd-Giraffe (Giraffa giraffa von Schreber, 1784)
- Massai-Giraffe (Giraffa tippelskirchi Matschie, 1898)
- Unterfamilie: Okapinae Bohlin, 1926
- Gattung: Okapia Lankester, 1901
- Okapi (Okapia johnstoni (Sclater, 1901))
Die Gattung Okapia ist monotypisch und enthält als einzige Art das Okapi. Zwar wurden zu Beginn des 20. Jahrhunderts mehrere Arten beschrieben, doch gelten diese heute alle als synonym zum eigentlichen Okapi.[12] Dagegen war innerhalb der Gattung Giraffa im Verlauf des 20. Jahrhunderts in der Regel nur eine Art anerkannt, die dann bis zu neun Unterarten einschloss. Molekulargenetische Untersuchungen aus dem Jahr 2007 ergaben aber nur einen geringen Genfluss zwischen diesen Unterarten. Die Autoren der Studien sprachen sich daher für eine Aufspaltung der Gattung in sechs Arten aus.[38][39] Aus diesen Analysen schlussfolgernd hoben Colin Peter Groves und Peter Grubb im Jahr 2011 in einer Revision der Huftiere acht Unterarten in den Artstatus.[40] Eine im Jahr 2016 vorgestellte DNA-Studie konnte innerhalb der Gattung Giraffa vier monophyletische Gruppen herausarbeiten, die demzufolge als tatsächliche Arten einzustufen wären. Hierbei handelt es sich um die Nord-Giraffe, die Süd-Giraffe, die Netzgiraffe und die Massai-Giraffe.[35] Im Jahr 2020 wurde dies im Rahmen einer weiteren genetischen Analyse auf drei Arten reduziert, die jedoch insgesamt zehn Unterarten einschließen (davon eine ausgestorben). Im Unterschied zum Vier-Arten-Modell bildet die Netzgiraffe in diesem Drei-Arten-Modell eine Unterart der Nord-Giraffe.[36] Wiederum genetische Studien aus dem Jahr 2021 schlussfolgern vier eigenständige Arten, weitgehend vergleichbar zu den Ergebnissen aus dem Jahr 2016, mit insgesamt sieben Unterarten.[37]
Fossil sind noch weitere Unterfamilien und Gattungen bekannt:[34][41][32][42][43][44][45][46]
- Gattung: Propalaeomeryx Lydekker, 1883
- Gattung: Progiraffa Pilgrim, 1908
- Gattung: Umbrotherium Abbrazzi, Delfino, Gallai, Trebini & Rook, 2008
- Gattung: Vishnutherium Lydekker, 1876
- Unterfamilie: Canthumerycinae Hamilton, 1978
- Gattung: Canthumeryx Hamilton, 1978
- Gattung: Georgiomeryx Paraskevaidis, 1940
- Unterfamilie: Palaeotraginae Pilgrim, 1911
- Gattung: Praepalaeotragus Godina, Vislobokova & Andrachmanova, 1993
- Gattung: Palaeotragus (+Achtiaria, Macedonitherium, Mitilanotherium, Orlovia, Sogdianotherium, Yuorlovia) Gaudrey, 1861
- Unterfamilie: Samotheriinae Hamilton, 1978
- Gattung: Shansitherium Killgus, 1923
- Gattung: Chersonotherium Alexejev, 1915
- Gattung: Samotherium Major, 1888
- Unterfamilie: Bohlininae Solounias, 2007
- Gattung: Injanatherium Heintz, Brunet & Sen, 1981
- Gattung: Bohlinia Matthew, 1929
- Gattung: Honanotherium Bohlin, 1927
- Gattung: Alcicephalus Rodler & Weithofer, 1890
- Gattung: Decennatherium Crusafont Pairó, 1952
- Unterfamilie: Okapinae Bohlin, 1926
- Gattung: Ua Solounias, Smith & Rios Ibàñez, 2022
- Gattung: Afrikanokeryx Harris, Solounias & Geraads, 2010
- Gattung: Csakvarotherium Kretzoi, 1930
- Unterfamilie: Giraffokerycinae Solounias, 2007
- Gattung: Giraffokeryx Pilgrim, 1910
- Unterfamilie: Sivatheriinae Bonaparte, 1850
- Gattung: Helladotherium (+ Panotherium, Maraghatherium) Gaudry, 1860
- Gattung: Birgerbohlinia Crusafont Pairó, 1952
- Gattung: Karsimatherium Meladze, 1962
- Gattung: Bramatherium (+ Hydaspitherium) Falconer, 1845
- Gattung: Libytherium Pomel, 1892
- Gattung: Sivatherium (+ Indratherium, Griquatherium, Orangiatherium) Falconer & Cautley, 1836
Stammesgeschichte
Ursprünge

Giraffenartige waren einst eine weit artenreichere Verwandtschaftsgemeinschaft als heute. Vorläufer der Familie finden sich in verschiedenen fossilen Gruppen, die überwiegend in Eurasien und in Afrika verbreitet waren und weitgehend im Unteren und Mittleren Miozän auftraten. Die Vertreter waren in ihrer Gestalt hirschähnlich und verfügten wie die Giraffen über fellüberzogene Hornzapfen, von denen sich ein Paar über den Augen erhob. Bei den Palaeomerycidae, eine sehr urtümliche giraffomorphe Gruppe, setzte zusätzlich noch ein drittes, einzelnes Horn am Hinterschädel an, das teilweise wie bei Xenokeryx aus dem Mittleren Miozän des westlichen Europas gegabelt war.[31] Auch die Climacoceratidae und Prolibytheriidae verfügten über geweihartig gegabelte Hörner, die teilweise bizarre und große Formen annahmen wie etwa bei Prolibytherium. Die Entwicklung derartig großer Stirnwaffen wurde durch die Herausbildung massiver Halswirbel begünstigt.[47][48] Andererseits hatten Vertreter wie Discokeryx ebenfalls kräftige Halswirbel und charakterisierten sich zudem über einen Schädel mit verdickter runder Kopfplatte, was als Anpassungen an Rivalenkämpfe gedeutet wird.[49] Als gemeinsames Merkmal wiesen die Angehörigen beider Gruppen außerdem einen gekerbten unteren Eckzahn auf, der eine typische Erscheinung der Giraffenartigen darstellt. Den oberen Eckzahn hatten sie dagegen schon reduziert. Sie stehen den Giraffenartigen dadurch möglicherweise näher als die Palaeomerycidae und gelten als basale giraffoide Linien.[34][32][50]
Miozän
Zu den frühesten Vertretern der Giraffenartigen wird teilweise Progiraffa gezählt, das sein frühestes Auftreten in den Siwaliks in Pakistan hat, wo es bereits im Unteren Miozän vor etwa 18 Millionen Jahren nachgewiesen ist. Die Form ist von verschiedenen Fundstellen in den Bugti-Bergen belegt. In der Regel liegen zumeist Gebissfragmente vor, allerdings sind auch Hornzapfen und Schädelteile sowie einzelne Elemente des Körperskeletts überliefert.[51][52] Die Stellung von Progiraffa innerhalb der Giraffenartigen ist nicht ganz eindeutig, manchmal wird auch eine nahe Verwandtschaft mit Prolibytherium gesehen.[34] Eindeutig zu den Giraffenartigen gehören aber die etwa im gleichen Zeitraum auftretenden Canthumerycinae mit ihrer Typusform Canthumeryx. Dieses war teilweise auch als Zarafa benannt, dem arabischen Ursprungswort (زرافة, (zarāfah)) für die „Giraffe“. Fossilien wurden zuerst in Nordafrika gefunden, etwa am Gebel Zelton in Libyen, weitere liegen aus der Lothidok-Formation in Ostafrika[53] und von der Arabischen Halbinsel vor. Die Tiere wurden etwa so groß wie ein Damhirsch und hatten kurze, konische Hörner, die oberhalb, hinter den Augen ansetzten und stark zueinander divergierten.[54][55] Ein naher Verwandter von Canthumeryx war Georgiomeryx, der unter anderem im Mittleren Miozän von der griechischen Insel Chios überliefert ist und dessen Hörner eine flachere Struktur hatten, aber ebenfalls eher seitlich abstanden.[56] Etwa zeitgleich traten im Mittleren Miozän erstmals Giraffenartige auf, die schon deutlich verlängerte Halswirbel und Langknochen aufwiesen. Hierzu zählt unter anderem Giraffokeryx aus der Gruppe der Giraffokerycinae, dessen Überreste unter anderem in Fort Ternan in Kenia,[32] in Çandır in Anatolien[57] und in der Chinji-Formation der Siwaliks in Pakistan[58][59] gefunden wurden. Es wies zwei Hornpaare auf, von denen die Hörner des vorderen kurz und rund im Querschnitt, die des hinteren lang und flach waren.[60][4][32] Die Chinji-Formation erbrachte überdies mit Ua einen ersten Beleg für die heute noch bestehende Gruppe der Okapinae. Die Funde umfassen Teile des Schädels und der Gliedmaßen. Sie führen zu der Annahme, dass die Okapi-Linie möglicherweise im südlichen Asien ihren Ursprung hatte.[45] Als weitere Form entstammt Vishnutherium ebenfalls der Gesteinseinheit. Deren verwandtschaftlichen Verhältnisse sind nicht eindeutig geklärt, das ihr zugewiesene Material bestehend aus Gebissresten wurde ursprünglich zu den ältesten Nachweisen von Giraffa gezählt. Von den Siwaliks aus verbreitete sich Vishnutherium in der Folgezeit bis nach Südostasien und Zentralasien, wo Reste aus Maragheh im Iran vorliegen.[46]



Zwei bedeutende Gruppen stellen die Palaeotraginae und die Samotheriinae dar, die vor allem im Oberen Miozän sehr dominant waren. Sie schließen äußerlich dem Okapi ähnliche mittelgroße bis große Tiere mit einem Paar unverzweigter, spitzer Hörner ein. Palaeotragus kam dabei über weite Teile Eurasiens und Afrikas vor und stellte eine sehr langlebige Form dar, die vom Mittleren Miozän bis zum Unteren Pleistozän bestand. Sie zeichnete sich durch leicht verlängerte Gliedmaßen und einen gestreckten Hals aus und besaß einen breiten Schädel, dem aber die typischen giraffenartigen Stirnhöhlen fehlten.[43] Funde kamen unter anderem in Thermopigi im nördlichen Griechenland zu Tage. Von hier liegen auch Reste von Samotherium vor.[61] Letztere Form war schon deutlich moderner und größer. Ihr langgestreckter Schädel ähnelte stärker dem der heutigen Giraffenartigen, der Hals übertraf bereits den des Okapis und die Halswirbel näherten sich in ihrer Form den entsprechenden Knochen bei den Giraffen an.[19] Die Typusfunde von Samotherium stammen von der griechischen Insel Samos, wo dessen fossile Knochen neben solchen vom pferdeartigen Hipparion und von einigen frühen Ziegenvertretern zu den häufigsten Funden aus jener Zeit gehören.[62] Die Verbreitung der Gattung reichte aber sehr weit, einzelne Schädel sind unter anderem aus Maragheh im Iran[63] und aus dem Linxia-Becken in der chinesischen Provinz Gansu überliefert. Dort trat Samotherium im Oberen Miozän gemeinsam mit Shansitherium auf. Beide Vertreter der Giraffenartigen ähnelten sich im Skelettbau, unterschieden sich aber unter anderem in der Struktur der Hörner, die bei Shansitherium an der Basis verwachsen waren, bei Samotherium hingegen nicht.[64]

In die Gruppe der Bohlininae wiederum gehört Bohlinia, eine stammesgeschichtlich entwickelte Form, die abgesehen von den Giraffen den längsten Hals und die längsten Beine in der Familie aufwies, zusätzlich auch zwei aufgerichtete Hörner. Die Bohlininae waren sehr weit verbreitet, wobei Bohlinia hauptsächlich aus dem südlichen Europa und westlichen Asien überliefert ist, bedeutende Funde kamen unter anderem in Kirokuçuk in Nordmazedonien,[65] in Nikitri in der griechischen Region Makedonien[66] und in Pikermi ebenfalls in Griechenland zu Tage. Andere Vertreter wie das kleine und ursprüngliche Injanatherium, das seitlich abstehende Hörner aufwies,[67] waren auf das westliche Asien beschränkt. Honanotherium wiederum stammt aus dem zentralen und östlichen Asien, hervorzuheben sind hier die umfangreichen Reste von Maragheh im Iran.[68][46] Eine dem gegenüber in Europa recht häufige Form findet sich mit Decennatherium. Mehrere Schädel und ein nahezu vollständiges Skelett wurden unter anderem aus Batallones-10 bei Torrejón de Velasco nahe Madrid in Spanien berichtet. Der Skelettfund weist auf ein Tier mit einer Körperhöhe von 2,8 m bei einer Körperlänge von 2,9 m und einem Gewicht von möglicherweise 1190 kg hin. Im Skelettbau stimmte die Form mit den Samotheriinae und Bohlininae weitgehend überein, die massigen, mit zahlreichen Rippeln ausgestatteten Hörner näherten sich hingegen den großen Sivatheriinae an.[69][70] Eventuell könnte auch das kleinere Umbrotherium in einer näheren Beziehung zu Decennatherium stehen. Die Gattung ist bisher nur über einige Zahn- und Gebissfragmente aus dem Oberen Miozän der Toskana und von Sardinien belegt.[41][71]
Zusätzlich sind im Oberen Miozän Vertreter der modernen Linien überliefert. Dazu gehört einerseits Afrikanokeryx aus der Gruppe der Okapinae, das über Schädelteile und Unterkieferfragmente aus Ngorora im westlichen Kenia belegt ist. Die Funde datieren auf ein Alter von etwa 9 Millionen Jahren.[32] Zudem sind auch erstmals die Giraffinae nachweisbar. Die Herkunft der heutigen langhalsigen Giraffen ist nicht eindeutig. So wird teilweise aufgrund von zahn- und schädelmorphologischen Merkmalen eine Herleitung von Palaeotragus befürwortet,[34] die Skelettanatomie unterstützt aber auch eine Abkunft von Bohlinia.[32] Die ältesten Fossilfunde der Gattung Giraffa stammen aus den Oberen Siwaliks in Südasien und haben ein Alter von rund 7,5 Millionen Jahren.[72][4][34][32]
In das Obere Miozän fällt ebenso der früheste Nachweis der Sivatheriinae oder Rindergiraffen, die einen erfolgreichen Seitenzweig der Giraffenartigen bildeten und extrem große, kräftige und kurzhalsige Tiere mit zwei Hornpaaren einschließen. Zu den frühen Formen zählen Helladotherium aus dem östlichen und südöstlichen Europa, etwa Thermopigi in Griechenland,[61][66][73] und Brahmatherium aus den Siwaliks.[42] Letzteres erreichte eine sehr weite Verbreitung und ist sowohl aus Südostasien[74] als auch Westasien[75] beziehungsweise von der griechischen Insel Samos belegt. Die Fundlagen auf Samos bargen zusätzlich auch das nahe verwandte Birgerbohlinia, das insgesamt aber nur über wenige Funde dokumentiert ist.[46] Die Sivatherien durchliefen eine fortschreitende Anpassung an einen schwerfälligen Gang in offeneren Landschaften etwa durch die Kürzung der Metapodien, was einen gegenläufigen Trend zu zahlreichen anderen Giraffenartigen darstellt. Auch bevorzugten sie eine eher gemischte Pflanzenkost mit einem höheren Anteil harter Gräser.[76]
Pliozän und Pleistozän

In Eurasien bestanden vor allem die Palaeotraginae weiter fort. So ist Palaeotragus noch bis in das Altpleistozän von Sésklo in Griechenland nachweisbar, wo unter anderem ein nahezu vollständiger Schädel mit rund 30 cm langen Hörnern gefunden wurde. Die Gattung war im Pliozän aber über weite Bereiche des südlichen Europas und zentralen Asiens verbreitet.[43] Sivatherium, die Charakterform der Sivatherien, entwickelte sich zu einem riesigen Tier mit der Statur eines Büffels und mit zwei Hornpaaren, von denen das hintere schaufelartig gestaltet war. Es besaß ein Körpergewicht von rund 1250 kg.[77] Die Form war im Jahr 1836 als erster ausgestorbener Vertreter der Giraffenartigen anhand eines massiven Schädels aus den Siwaliks beschrieben worden.[78] Sie ist dort regelmäßig in Form von Gebissresten belegt,[79] konnte aber auch an zahlreichen Fossilfundstellen in Eurasien nachgewiesen werden, so unter anderem in Stamer près de Delcevo im nordwestlichen Nordmazedonien.[65] Darüber hinaus sind auch aus Afrika Funde bekannt, etwa von Langebaanweg im südwestlichen Südafrika.[32] Im Übergang vom Oberen Miozän zum Pliozän erreichte Giraffa ebenfalls den afrikanischen Kontinent und bildete dort eigene Entwicklungslinien aus, die sowohl zu den heutigen Arten führten, als auch zwergenhafte Formen einschließen. Die langhälsigen Giraffen bewohnten im Pliozän und Pleistozän weite Teile des östlichen und südlichen und mitunter auch des zentralen Afrikas. Relativ zahlreich belegt sind sie unter anderem in Koobi Fora und in der Olduvai-Schlucht in Ostafrika.[4][32]
Forschungsgeschichte

Carl von Linné hatte die Giraffen mit dem damals einzigen bekannten Vertreter – der heutigen Nord-Giraffe – in der zehnten Auflage sines Werkes Systema naturae im Jahr 1758 unter der Bezeichnung Cervus camelopardalis zu den Hirschen gestellt.[80] Dies wurde bereits vier Jahre später von Mathurin-Jacques Brisson korrigiert, indem er die Gattung Giraffa kreierte.[81] Die offizielle Einführung der Gattung Giraffa wurde lange Zeit aber Morten Thrane Brünnich zugesprochen, der die Bezeichnung 1772 gebrauchte,[82] allerdings änderte dies ein Beschluss der ICZN im Jahr 1998 zugunsten von Brisson.[83] Auf Giraffa beruht auch der wissenschaftliche Gattungsname Giraffidae, der wiederum von John Edward Gray aus dem Jahr 1821 stammt. Seine kurze Merkmalsbeschreibung der Familie lautete: Frontal bone in both sexes lengthened into two solid, conical, permanent processes, covered with a permanent, hairy skin („Stirnbein bei beiden Geschlechtern zu zwei festen, konischen, dauerhaften Fortsätzen verlängert, bedeckt mit dauerhaftem Fell“).[84] Im Jahr 1825 wiederum hatte Gray die Bezeichnung Camelopardina als Untergruppe der Hornträger eingeführt,[85] während wiederum sechs Jahre später Charles Lucien Jules Laurent Bonaparte die Familie Camelopardalidae begründete (die Gattungsbezeichnung Camelopardalis geht auf Johann Christian von Schreber zurück, der diese im Jahr 1784 in seinem Werk Die Säugethiere in Abbildungen nach der Natur mit Beschreibungen gebrauchte, auch Pieter Boddaert benutzte sie nur ein Jahr später[86]).[87] Vor allem im 19. Jahrhundert wurde die Familienzuweisung Camelopardalidae teilweise verwendet.[88] Über die systematische Stellung der Giraffenartigen gab es seit der ersten Artbenennung durch Linnaeus kaum Debatten. Dieser hatte die heutige Nord-Giraffe innerhalb der Gattung Cervus zusammen mit den Gattungen Bos, Capra, Ovis und Moschus (zuzüglich Camelus) in die Gruppe der Stirnwaffenträger (Pecora) gestellt.[80] Die genaue Verwandtschaft zu den anderen Vertretern der Stirnwaffenträger war jedoch nicht unumstritten. So wurde teilweise eine nähere Beziehung zu den Hornträgern (Bovidae) oder zu den Hirschen (Cervidae) bevorzugt. Die Giraffenartigen galten im Verlauf des 19. Jahrhunderts zumeist als rezent monotypische Familie mit lediglich den Giraffen als einzigem anerkannten Gattungsvertreter. Erst mit der Entdeckung des Okapis im Jahr 1901[89][90] wurde ihnen ein weiterer Vertreter zur Seite gestellt.[91]
Literatur
- John M. Harris, Nikos Solounias und Denis Geraads: Giraffoidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, Los Angeles, London, 2010, S. 797–811
- Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London 2013, S. 95–115
- J. D. Skinner und G. Mitchell: Family Giraffidae (Giraffe and Okapi). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 788–802
Einzelnachweise
- Sybrand J. van Sittert, John D. Skinner und Graham Mitchell: From fetus to adult - an allometric analysis of the giraffe vertebral column. Journal of Experimental Zoology B 314, 2010, S. 469–479
- C. A. Spinage: Horns and other bony structures of the skull of the Giraffe and their functional significance. East African Wildlife Journal 6, 1968, S. 53–61
- Anne Innes Dagg: External features of giraffe. Mammalia 32, 1968, S. 657–669
- G. Mitchell und J. D. Skinner: On the origin, evolution and phylogeny of giraffes Giraffa camelopardalis. Transactions of the Royal Society of South Africa 58 (1), 2003 S. 51–73
- J. D. Skinner und G. Mitchell: Family Giraffidae (Giraffe and Okapi). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 788–802
- Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London 2013, S. 98–110
- Ray Lankester: On Okapia, a new Genus of Giraffidae, from Central Africa. Transactions of the Zoological society of London 1902 (2), S. 279–315
- N. Solounias und N. Tang: The two types of cranial appendages in Giraffa camelopardalis (Mammalia, Artiodactyla). Journal of Zoology London 222, 1990, S. 293–302
- C. A. Spinage: The median ossicone of Giraffa camelopardalis. Journal of Zoology London 230, 1993, S. 1–5
- Yu Wang, Chenzhou Zhang, Nini Wang, Zhipeng Li, Rasmus Heller, Rong Liu, Yue Zhao, Jiangang Han, Xiangyu Pan, Zhuqing Zheng, Xueqin Dai, Ceshi Chen, Mingle Dou, Shujun Peng, Xianqing Chen, Jing Liu, Ming Li, Kun Wang, Chang Liu, Zeshan Lin, Lei Chen, Fei Hao, Wenbo Zhu, Chengchuang Song, Chen Zhao, Chengli Zheng, Jianming Wang, Shengwei Hu, Cunyuan Li, Hui Yang, Lin Jiang, Guangyu Li, Mingjun Liu, Tad S. Sonstegard, Guojie Zhang, Yu Jiang, Wen Wang und Qiang Qiu: Genetic basis of ruminant headgear and rapid antler regeneration. Science 364 (6446), 2019, S. eaav6335, doi:10.1126/science.aav6335
- Anne Innes Dagg: Sexual differences in the giraffe skull. Mammalia 29, 1965, S. 610–612
- Richard E. Bodmer und George B. Rabb: Okapia johnstoni. Mammalian Species 422, 1992, S. 1–8
- N. Ludos Badlangana, Justin W. Adams und Paul R. Manger: The giraffe (Giraffa camelopardalis) cervical vertebral column: a heuristic example in understanding evolutionary processes? Zoological Journal of the Linnean Society 155, 2009, S. 736–757
- Melinda Danowitz und Nikos Solounias: The Cervical Osteology of Okapia johnstoni and Giraffa camelopardalis. PLoS ONE 10 (8), 2015, S. e0136552, doi:10.1371/journal.pone.0136552
- Ray Lankester: On certain points in the structure of the cervical vertebrae of the okapi and giraffe. Proceedings of the Zoological Society of London 1908, S. 320–334
- N. Solounias: The remarkable anatomy of the giraffe’s neck. Journal of Zoology London 247, 1999, S. 257–268
- Marilena A. Müller, Luisa J. F. Merten, Christine Böhmer und John A. Nyakatura: Pushing the boundary? Testing the “functional elongation hypothesis” of the giraffe’s neck. Evolution, 2021, doi:10.1111/evo.14171
- Melinda Danowitz, Aleksandr Vasilyev, Victoria Kortlandt und Nikos Solounias: Fossil evidence and stages of elongation of the Giraffa camelopardalis neck. Royal Society open science 2, 2015, S. 150393, doi:10.1098/rsos.150393
- Melinda Danowitz, Rebecca Domalski und Nikos Solounias: The cervical anatomy of Samotherium, an intermediate-necked giraffid. Royal Society open science 2, 2015, S. 150521, doi:10.1098/rsos.150521
- William J. Silvia, Charles H. Hamilton und William F. Silvia: The occurrence of metatarsal splint bones in ruminants and their potential use in establishing phylogenetic relationships. Zitteliana B 32, 2014, S. 155–162, doi:10.5282/ubm/epub.22392
- María Ríos, Melinda Danowitz und Nikos Solounias: First comprehensive morphological analysis on the metapodials of Giraffidae. Palaeontologia Electronica 19 (3), 2016, S. 50A, doi:10.26879/653
- Anne Innis Dagg: Gaits of the Giraffe and Okapi. Journal of Mammalogy 41 (2), 1960, S. 282
- Anne Innis Dagg: The Role of the Neck in the Movements of the Giraffe. Journal of Mammalogy 43 (1), 1962, S. 88–97
- Robert E. Simmons und Lue Sheepers: Winning by a neck: Sexual selection in the evolution of Giraffe. The American Naturalist 148 (5), 1996, S. 771–786
- Juan P. Zurano, Felipe M. Magalhães, Ana E. Asato, Gabriel Silva, Claudio J. Bidau, Daniel O. Mesquita und Gabriel C. Costa: Cetartiodactyla: Updating a time-calibrated molecular phylogeny. Molecular Phylogenetics and Evolution 133, 2019, S. 256–262
- Alexandre Hassanin und Emmanuel J. P. Douzery: Molecular and Morphological Phylogenies of Ruminantia and the Alternative Position of the Moschidae. Systematic Biology 52 (2), 2003, S. 206–228
- Ingi Agnarsson und Laura J. May-Collado: The phylogeny of Cetartiodactyla: The importance of dense taxon sampling, missing data, and the remarkable promise of cytochrome b to provide reliable species-level phylogenies. Molecular Phylogenetics and Evolution 48, 2008, S. 964–985
- Alexandre Hassanin, Frédéric Delsuc, Anne Ropiquet, Catrin Hammer, Bettine Jansen van Vuuren, Conrad Matthee, Manuel Ruiz-Garcia, François Catzeflis, Veronika Areskoug, Trung Thanh Nguyen und Arnaud Couloux: Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), as revealed by a comprehensive analysis of mitochondrial genomes. Comptes Rendus Palevol 335, 2012, S. 32–50
- Fayasal Bibi: A multi-calibrated mitochondrial phylogeny of extant Bovidae (Artiodactyla, Ruminantia) and the importance of the fossil record to systematics. BMC Evolutionary Biology 13, 2013, S. 166
- Lei Chen, Qiang Qiu, Yu Jiang, Kun Wang, Zeshan Lin, Zhipeng Li, Faysal Bibi, Yongzhi Yang, Jinhuan Wang, Wenhui Nie, Weiting Su, Guichun Liu, Qiye Li, Weiwei Fu, Xiangyu Pan, Chang Liu, Jie Yang, Chenzhou Zhang, Yuan Yin, Yu Wang, Yue Zhao, Chen Zhang, Zhongkai Wang, Yanli Qin, Wei Liu, Bao Wang, Yandong Ren, Ru Zhang, Yan Zeng, Rute R. da Fonseca, Bin Wei, Ran Li, Wenting Wan, Ruoping Zhao, Wenbo Zhu, Yutao Wang, Shengchang Duan, Yun Gao, Yong E. Zhang, Chunyan Chen, Christina Hvilsom, Clinton W. Epps, Leona G. Chemnick, Yang Dong, Siavash Mirarab, Hans Redlef Siegismund, Oliver A. Ryder, M. Thomas P. Gilbert, Harris A. Lewin, Guojie Zhang, Rasmus Heller und Wen Wang: Large-scale ruminant genome sequencing provides insights into their evolution and distinct traits. Science 364 (6446), 2019, S. eaav6202, doi:10.1126/science.aav6202
- Israel M. Sánchez, Juan L. Cantalapiedra, María Ríos, Victoria Quiralte und Jorge Morales: Systematics and Evolution of the Miocene Three-Horned Palaeomerycid Ruminants (Mammalia, Cetartiodactyla). PlosOne 10 (12), 2015, S. e0143034
- John M. Harris, Nikos Solounias und Denis Geraads: Giraffoidea. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, Los Angeles, London, 2010, S. 797–811
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 432–434)
- Nikos Solounias: Family Giraffidae. In: Donald R. Prothero und Scott E. Foss (Hrsg.): The Evolution of Artiodactyls. Johns Hopkins University, Baltimore, 2007, S. 257–277
- Julian Fennessy, Tobias Bidon, Friederike Reuss, Vikas Kumar, Paul Elkan, Maria A. Nilsson, Melita Vamberger, Uwe Fritz und Axel Janke: Multi-locus Analyses Reveal Four Giraffe Species Instead of One. Current Biology 26, 2016 ()
- Alice Petzold, Anne-Sophie Magnant, David Edderai, Bertrand Chardonnet, Jacques Rigoulet, Michel Saint-Jalme und Alexandre Hassanin: First insights into past biodiversity of giraffes based on mitochondrial sequences from museum specimens. European Journal of Taxonomy 703, 2020, S. 1–33, doi:10.5852/ejt.2020.703
- Raphael T. F. Coimbra, Sven Winter, Vikas Kumar, Klaus-Peter Koepfli, Rebecca M. Gooley, Pavel Dobrynin, Julian Fennessy und Axel Janke: Whole-genome analysis of giraffe supports four distinct species. Current Biology 31, 2021, S. 1–10, doi:10.1016/j.cub.2021.04.033
- David M. Brown, Rick A Brenneman, Klaus-Peter Koepfli, John P Pollinger, Borja Milá, Nicholas J Georgiadis, Edward E Louis Jr, Gregory F Grether, David K Jacobs und Robert K Wayne: Extensive population genetic structure in the giraffe. BMC Biology 5, 2007, S. 57, doi:10.1186/1741-7007-5-57
- Alexandre Hassanin, Anne Ropiquet, Anne-Laure Gourmand, Bertrand Chardonnet, Jacques Rigoulet: Mitochondrial DNA variability in Giraffa camelopardalis: consequences for taxonomy, phylogeography and conservation of giraffes in West and central Africa. Comptes Rendus Biologies 330, 2007, S. 265–274, doi:10.1016/j.crvi.2007.02.008
- Colin Groves und Peter Grubb: Ungulate Taxonomy. Johns Hopkins University Press, 2011, S. 1–317 (S. S. 108–280)
- Laura Abbazzi, Massimo Delfino, Gianni Gallai, Luciano Trebini und Lorenzo Rook: New data on the vertebrate assemblage of Fiume Santo (North-West Sardinia, Italy), and overview on the late Miocene Tusco-Sardinian palaeobioprovince. Palaeontology 51, 2008, S. 425–451, doi:10.1111/j.1475-4983.2008.00758.x
- Muhammad Akbar Khan, Muhammad Akhtar und Ammara Irum: Bramatherium (Artiodactyla, Ruminantia, Giraffidae) from the Middle Siwaliks of Hasnot, Pakistan: biostratigraphy and palaeoecology. Turkish Journal of Earth Sciences 23, 2014, S. 308–320
- Athanassios Athanassiou: New giraffid (Artiodactyla) material from the Lower Pleistocene locality of Sésklo (SE Thessaly, Greece): evidence for an extension of the genus Palaeotragus into the Pleistocene. Zitteliana B 32, 2014, S. 71–89, doi:10.5282/ubm/epub.22388
- María Ríos, Sayyed Ghyour Abbas, Muhammad Akbar Khan und Nikos Solounias: Distinction of Sivatherium from Libytherium and a new species of Libytherium (Giraffidae, Ruminantia, Mammalia) from the Siwaliks of Pakistan (Miocene). Geobios 74, 2022, S. 67–76, doi:10.1016/j.geobios.2022.06.002
- Nikos Solounias, S. Smith und M. Rios Ibàñez: Ua pilbeami: a new taxon of Giraffidae (Mammalia) from the Chinji Formation of Pakistan with phylogenetic proximity to Okapia. Bollettino della Società Paleontologica Italiana 61 (3), 2022, S. 319–326, doi:10.4435/BSPI.2022.19
- Nikos Solounias und Advait M. Jukar: A Reassessment of Some Giraffidae Specimens from the Late Miocene Faunas of Eurasia. In:Isaac Casanovas-Vilar, Lars W. van den Hoek Ostende, Christine M. Janis und Juha Saarinen (Hrsg.): Evolution of Cenozoic Land Mammal Faunas and Ecosystems: 25 Years of the NOW Database of Fossil Mammals. Vertebrate Paleobiology and Paleoanthropology Series, Springer, 2023, S. 189–199
- Israel M. Sanchez, Victoria Quiralte, Jorge Morales, Beatriz Azanza und Martin Pickford: Sexual dimorphism of the frontal appendages of the Early Miocene African pecoran Prolibytherium Marambourg, 1961 (Mammalia, Ruminanta). Journal of Vertebrate Paleontology 30 (4), 2010, S. 1306–1310
- Melinda Danowitz, Rebecca Domalski und Nikos Solounias: A New Species ofProlibytherium(Ruminantia, Mammalia) from Pakistan, and the Functional Implications of an Atypical Atlanto-Occipital Morphology. Journal of Mammalian Evolution 23, 2016, S. 201–207, doi:10.1007/s10914-015-9307-8
- Shi-Qi Wang, Jie Ye, Jin Meng, Chunxiao Li, Loïc Costeur, Bastien Mennecart, Chi Zhang, Ji Zhang, Manuela Aiglstorfer, Yang Wang, Yan Wu, Wen-Yu Wu und Tao Deng: Sexual selection promotes giraffoid head-neck evolution and ecological adaptation. Science 376 (6597), 2022, S. eabl8316, doi:10.1126/science.abl8316
- Israel M. Sánchez, Jorge Morales, Juan López Cantalapiedra, Victoria Quiralte und Martin Pickford: Propalaeoryx Stromer 1926 (Ruminantia, Pecora, Giraffomorpha) revisited: systematics and phylogeny of an African palaeomerycoid. Communications of the Geological Survey of Namibia 19, 2017, S. 123–131
- John C. Barry, Susanne Cote, Laura MacLatchy, Everett H. Lindsay, Robert Kityo, Robert und A. Rahim Rajpar: Oligocene and Early Miocene Ruminants (Mammalia, Artiodactyla) from Pakistan and Uganda. Palaeontologia Electronica 8 (1), 2005, S. 22A ()
- Kiran Aftab, Muhammad Akbar Khan, Zaheer Ahmad und Muhammad Akhtar: Progiraffa (Artiodactyla: Ruminantia: Giraffidae) from the Lower Siwalik Subgroup (Miocene) of Pakistan. Alcheringa: An Australasian Journal of Palaeontology 96, 2016, S. 489–506, doi:10.1080/03115518.2016.1109295
- Ari Grossman und Nikos Solounias: New fossils of Giraffoidea (Mammalia: Artiodactyla) from the Lothidok Formation (Kalodirr Member, Early Miocene, West Turkana, Kenya) contribute to our understanding of early giraffoid diversity. Zitteliana B 32, 2014, S. 63–70, doi:10.5282/ubm/epub.22387
- W. R. Hamilton: The lower Miocene ruminants of Gebel Zelten, Libya. Bulletin of the British Museum of Natural History 21 (3), 1973, S. 73–150
- W. R. Hamilton: Fossil giraffes from the Miocene of Africa and a revision of the phylogeny of the Giraffoidea. Philosophical Transactions of the Royal Society B 283, 1978, S. 165–229
- Louis de Bonis, George D. Koufos und Sevket Sen: A giraffid from the Middle Miocene of the island of Chios, Greece. Palaeontology 40 (1), 1997, S. 121–133
- Denis Geraads und Fehmi Aslan: Giraffidae from the middle Miocene hominoid locality of Çandır (Turkey). Courier Forschungsinstitut Senckenberg 240, 2003, S. 201–209
- K. Aftab, Z. Ahmed, M. A. Khan und M. Akhtar: Giraffokeryx (Artiodactyla: Ruminantia: Giraffidae) from the Potwar Plateau Middle Miocene, Pakistan. The Journal of Animal & Plant Sciences 24 (4), 2014, S. 1091–1100
- Zafar Hameed Bhatti, Muhammad Akbar Khan, Muhammad Akhtar, Abdul Majid Khan, Abdul Ghaffar, Mehboob Iqbal und Tasneem Ikram: Giraffokeryx (Artiodactyla: Mammalia) Remains From the Lower Siwaliks of Pakistan. Pakistan Journal of Zoology 44 (6), 2012, S. 1623–1631
- Edwin H. Colbert: A skull and mandible of Giraffokeryx punjabiensis (Pilgrim). American Museum Novitates 632, 1933, S. 1–14
- Alexandros Xafis, Evangelia Tsoukala, Nikos Solounias, Oleg Mandic, Mathias Harzhauser, Friðgeir Grímsson und Doris Nagel: Fossil Giraffidae (Mammalia, Artiodactyla) from the late Miocene of Thermopigi (Macedonia, Greece). Palaeontologia Electronica 22, 2019, S. 3.67, doi:10.26879/889
- Dimitris S. Kostopoulos: The Late Miocene Mammal Faunas of the Mytilinii Basin, Samos Island, Greece: New Collection. 13. Giraffidae. Beiträge zur Paläontologie 31, 2009, S. 299–343
- Elnaz Parizad, Majid Mirzaie Ataabadi, Marjan Mashkour und Dimitris S. Kostopoulos: Samotherium Major, 1888 (Giraffidae) skulls from the late Miocene Maragheh fauna (Iran) and the validity of AlcicephalusRodler & Weithofer, 1890. Comptes Rendus Palevol 19 (9), 2020, S. 153–172, doi:10.5852/cr-palevol2020v19a9
- Sukuan Hou, Michael Cydylo, Melinda Danowitz und Nikos Solounias: Comparisons of Schansitherium tafeli with Samotherium boissieri (Giraffidae, Mammalia) from the Late Miocene of Gansu Province, China. PLo SONE 14 (2), 2019, S. e0211797, doi:10.1371/journal.pone.0211797
- Denis Geraads: Giraffidae (Mammalia) de la fin du Néogène de la République de Macédoine (ARYM). Geodiversitas 31 (4), 2009, S. 893–908
- Dimitris S. Kostopoulos, Kalliopi K. Koliadimou und George D. Koufos: The giraffids (Mammalia, Artiodactyla) from the Late Miocene mammalian localities of Nikiti (Macedonia, Greece). Palaeontographica Abteilung A 239, 1996, S. 61–88
- Emile Heintz, Michel Brunet und Sevket Sen: Un nouveau Giraffidé du Miocène supérieur d’Irak: Injanatherium hazimi n. g., n. sp. Comptes Rendus de l’Académie des Sciences Série II 292, 1981, S. 423–426
- Nikos Solounias und Melinda Danowitz: The Giraffidae of Maragheh and the identification of a new species of Honanotherium. Palaeobiodiversity and Palaeoenvironments, 2016, doi:10.1007/s12549-016-0230-7
- María Ríos, Israel M. Sánchez und Jorge Morales: A new giraffid (Mammalia, Ruminantia, Pecora) from the late Miocene of Spain, and the evolution of the sivathere-samothere lineage. PLoS ONE 12 (11), 2017, S. e0185378, doi:10.1371/journal.pone.0185378
- María Ríos und Jorge Morales: A new skull of Decennatherium rex Ríos, Sánchez and Morales, 2017 from Batallones-4 (upper Vallesian, MN10, Madrid, Spain). Palaeontologia Electronica 22, 2019, S. 2.pvc_1, doi:10.26879/965
- Luca Pandolfi und Lorenzo Rook: An enigmatic giraffid from the latest Miocene of Italy: Taxonomy, affinity, and paleobiogeographic implications. Journal of Mammalian Evolution, 2023, doi:10.1007/s10914-023-09654-8
- Zafar Hameed Bhatti, Muhammad Akbar Khan, Muhammad Akhtar, Abdul Majid Khan, Abdul Ghaffar, Mahboob Iqbal und Muhammad Khaled Siddiq: Giraffa punjabiensis (Giraffidae: Mammalia) from Middle Siwaliks of Pakistan. Pakistan Journal of Zoology 44 (6), 2012, S. 1689–1695
- Denis Geraads, Nikola Spassov und Dimitar Kovachev: Giraffidae (Artiodactyla, Mammalia) from the Late Miocene of Kalimantsi and Hadjidimovo, Southwestern Bulgaria. Geologica Balcanica 35 (1/2), 2005, S. 11–18
- Yuichiro Nishioka, Rattanaphorn Hanta und Pratueng Jintasakul: Note on giraffe remains from the Miocene of continental Southeast Asia. Journal of Science and Technology MSU 33 (4), 2014, S. 365–377
- Denis Geraads und Erksin Güleç: A Bramatherium skull (Giraffidae, Mammalia) from the Late Miocene of Kavakdere (Central Turkey). Biogeographic and phylogenetic implications. Bulletin of The Mineral Research and Exploration 121, 1999, S. 51–56
- Alan W. Gentry, Gertrud E. Rössner und Elmar P. J. Heizmann: Suborder Ruminantia. In: Gertrud E. Rössner und Kurt Heissig: The Miocene land mammals of Europe. München, 1999, S. 225–257
- Christopher Basu, Peter L. Falkingham und John R. Hutchinson: The extinct, giant giraffid Sivatherium giganteum: skeletal reconstruction and body mass estimation. Biology Letters 12, 2016, S. 20150940, doi:10.1098/rsbl.2015.0940
- Hugh Falconer und Proby Thomas Cautley: Sivatherium giganteum, a new fossil ruminant genus. Asiatic Researches 19, 1836, S. 1–25 ()
- A. A. Khan, M. A. Khan, M. Iqbal, M. Akhtar und M. Sarwar: Sivatherium (Artiodactyla, Ruminantia, Giraffidae) from the Upper Siwaliks, Pakistan. The Journal of Animal & Plant Sciences 21 (2), 2011, S. 202–206
- Carl von Linné: Systema naturae. 10. Auflage, 1758, S. 66 ()
- Mathurin-Jacques Brisson: Regnum animale in classes IX distributum sive Synopsis methodica. Haak, Paris, Leiden 1756–1762, S. 1–296 (S. 36) ()
- Morten Thrane Brünnich: Zoologiae fundamenta praelectionibus academicis accommodata = Grunde i dyrelaeren. Hafniae et Lipsiae, 1772, S. 1–253 (S. 36) ()
- Peter Grubb: Giraffa camelopardalis. In: Don E. Wilson und DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. A taxonomic and geographic Reference. Johns Hopkins University Press, Baltimore MD 2005 ()
- John Edward Gray: On the natural arrangement of vertebrose animals. London Medical Repository 15, 1821, S. 297–310 (307) ()
- John Edward Gray: An outline of an attempt at the disposition of Mammalia into tribes and families, with a list of the genera apparently pertaining to each tribe. Annals of Philosophy 10, 1825, S. 337–344 ()
- Anne Innes Dagg: Giraffa camelopardis. Mammalian Species 5, 1971, S. 1–8
- Charles Lucien Jules Laurent Bonaparte: Saggio di una distribuzione metodica degli animali vertebrati. Rome, 1831, S. 1–144 (S. 24) ()
- Philip Lutley Sclater: On the systematic position of the Pronghorn (Antilocapra americana). The Annals and magazine of natural history 18, 1866, S. 401–404 ()
- Philip Lutley Sclater: On a apparently new species of Zebra from the Semliki forest. Proceedings of the Zoological Society of London, 1901, S. 50–52 ()
- Ray Lankester: Two skulls and a skin of the new mammal, the Okapi, On Okapia, discoverd by Sir Harry Johnston. Proceedings of the Zoological Society of London, 1901, S. 279–281 ()
- George Gaylord Simpson: The principles of classification and a classification of mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 84–85)