Gastrektomie
Als Gastrektomie (griechisch γαστρεκτομή, vergleiche altgriechisch γαστήρ gastér und die Ektomie) oder totale Magenresektion wird im medizinischen Sprachgebrauch die vollständige Entfernung (Totalexstirpation oder totale Exstirpation) des Magens bezeichnet. Sie wird in der Regel zur Behandlung des Magenkarzinoms erforderlich. Abzugrenzen ist die (totale) Gastrektomie von der Magenresektion, bei der nur ein Teil des Magens entfernt wird zur Behandlung gutartiger Erkrankungen des Magens und Zwölffingerdarms (Duodenum).
Die ersten Gastrektomien führten Phineas S. Connor aus Cincinnati am 7. Dezember 1883 (mit tödlichem Ausgang)[1][2] und (ebenfalls mit fatalem Ausgang) Jules Emile Péan[3] sowie erfolgreich (allerdings unter Zurücklassung eines winzigen Magenschleimhautanteils bei der 14 Monate nach der Operation an Metastasen gestorbenen Patientin)[4] Carl B. Schlatter am 6. September 1897 (als vertretender Oberarzt von Rudolf Ulrich Krönlein) in Zürich[5] und C. B. Brigham im Februar 1898 in San Francisco[6] durch.[7] Mit Schlatters totaler Gastrektomie war bewiesen, dass ein Leben ohne Magen möglich ist.
Indikationen


Eine absolute Indikation zur Gastrektomie ist das kurativ entfernbare Magenkarzinom, es sei denn, der Allgemeinzustand des Patienten lässt einen so großen Eingriff nicht zu. Nur in Ausnahmefällen, wenn ein sehr kleiner Tumor (Stadium bis T1) nahe am Magenausgang (Antrum) liegt, kann eine 4/5-Magenresektion durchgeführt werden.
Regelhaft gehört zur Tumor-Gastrektomie die systematische Lymphknotenausräumung, je nach Lage und Größe des Tumors muss gegebenenfalls eine erweiterte Gastrektomie vorgenommen werden. Häufig wird hier die Milz und der Schwanz der Bauchspeicheldrüse mitentfernt („abdominal erweiterte linksregionale Gastrektomie“).
Bei sehr distal gelegenem Tumor muss gegebenenfalls der Zwölffingerdarm (Duodenum) und der Kopf der Bauchspeicheldrüse teilweise entfernt werden (partielle Duodenopankreatektomie), man spricht dann von einer „abdominal erweiterten rechtsregionalen Gastrektomie“.
Als „transmediastinal erweiterten Gastrektomie“ wird die Gastrektomie mit Entfernung des unteren Drittels der Speiseröhre bezeichnet. Dieser Eingriff ist bei sehr hohem Tumorsitz im Bereich der Cardia erforderlich.
Selten ergeben sich Indikationen zur Gastrektomie bei gutartigen Erkrankungen: Das Mallory-Weiss-Syndrom ist eine blutende (hämorrhagische) Entzündung der Schleimhaut im unteren Bereich der Speiseröhre (Ösophagus) und/oder im Bereich des Mageneingangs (Kardia) und kann im Extremfall zu anderweitig nicht stillbaren Massenblutungen führen. Das Ulcus Dieulafoy ist ein seltenes, hoch an der Kardia sitzendes Magengeschwür, gelegentlich mit heftiger arterieller Blutung; gelingt hier eine endoskopische Blutstillung nicht, muss gegebenenfalls notfallmäßig eine Gastrektomie erfolgen.[8]
Schmerzausschaltung, Lagerung und Zugang
Die Gastrektomie wird ausschließlich in Intubationsnarkose vorgenommen. Ein zusätzlich vor der Operation (präoperativ) gelegter Peridural-Katheter hilft während und nach der Operation unter anderem bei der Schmerzausschaltung.
Der Eingriff wird in Rückenlagerung mit etwas Überstreckung der unteren Brustwirbelsäule durchgeführt. Als Zugang kann der Oberbauchlängsschnitt (mediane Oberbauchlaparotomie) bei schlanken Patienten ausreichen, eine bessere Übersicht bietet eine Kombination aus Längs- und Querlaparotomie im Sinne eines auf dem Kopf stehenden T. Hiermit lässt sich auch eine der oben beschriebenen Erweiterungen ohne Probleme durchführen. Das Operationsfeld wird durch ein so genanntes Retraktorsystem offen gehalten.
Im Falle der erforderlichen transmediastinalen Erweiterung muss der Zugang gelegentlich um eine rechtsseitige Eröffnung des Brustkorbs (Thorakotomie) ergänzt und die Operation als „Zweihöhleneingriff“ (Brusthöhle und Bauchhöhle eröffnet) durchgeführt werden.
Neben der offenen chirurgischen Technik kann die Gastrektomie auch vollständig laparoskopisch erfolgen.
Entfernung des Magens und Lymphadenektomie

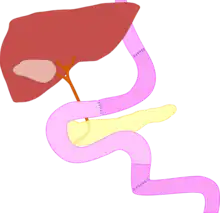
Die Gastrektomie beginnt mit der Ablösung des linken Leberlappens vom Zwerchfell zur Freilegung des unteren Ösophagus, um vorab festzustellen, ob der Eingriff abdominal durchführbar ist oder eine Thorakotomie nötig wird. Dann wird das große Netz (Omentum majus) vom Dickdarm abgelöst und somit die Bursa omentalis eröffnet. Jetzt kann die Ausbreitung des Tumors in das Retroperitoneum beurteilt werden, also in Richtung Bauchspeicheldrüse und linker Niere.
Die Blutversorgung der großen Kurvatur (s. erstes Bild), bestehend aus der Arteria gastroomentalis dextra und der Arteria gastroomentalis sinistra sowie den begleitenden Venen wird abgangsnah durchtrennt. Es folgt die Eröffnung des kleinen Netzes Omentum minus, das Aufsuchen der Arteria gastrica dextra nahe am Pylorus und Durchtrennen derselben. Der obere Zwölffingerdarm wird nun knapp unterhalb des Pylorus durchtrennt; hierzu wird meist ein Klammernahtgerät (Stapler) verwendet. Im Bereich der durchtrennten Arterienstümpfe nahe der Bauchschlagader (Aorta abdominalis) wird nun mit der Lymphadenektomie begonnen. Hierbei wird das lymphknotenhaltige Bindegewebe über der Leberarterie (Arteria hepatica communis), der Milzarterie (Arteria splenica) entlang der Oberkante der Bauchspeicheldrüse und der Zwölffingerdarm-Arterie (Arteria gastroduodenalis) entfernt und diese Arterien somit völlig freigelegt. Am gemeinsamen Ursprung dieser Arterien (Truncus coeliacus) wird das Lymphgewebe bis zur Bauchschlagader entfernt. Die kurzen Arterien zwischen Milz und Magen (Arteriae gastricae breves) werden jetzt durchtrennt und die große Kurvatur bis zur Speiseröhre freigelegt. Im Fall der linksregionalen Erweiterung werden die kurzen Arterien belassen und die Milz an Gefäßstiel abgesetzt. Nun kann der Endabschnitt der Speiseröhre ebenfalls mit einem Stapler durchtrennt werden. Als Präparat entfallen nun en-bloc der Magen, das große Netz und die Milz.
Magenersatz
Es existieren etwa 100 Methoden für den („plastischen“[9]) Magenersatz.[10][11] Hier werden daher nur die drei wichtigen Grundformen erläutert.
Ösophagoduodenostomie mit Dünndarminterposition
Zwischen Ösophagus- und Duodenalstumpf wird ein isoliertes, an seiner Gefäßversorgung belassenes Teilstück des Dünndarms (Jejunum) eingenäht. Bevorzugt wird wegen seiner guten Beweglichkeit das Jejunum verwendet. Die Verbindung zwischen Ösophagus und dem Interponat („Ösophago-Jejunostomie“) kann als End-zu-Seit-Anastomose oder mit einer zusätzlichen „Jejunoplicatio“, einer Umschlingung der Anastomose mit dem oberen Dünndarmteil, ausgeführt werden. Diese hat den Zweck, als Ersatz für die Ventilfunktion der Kardia einen Reflux zu verhindern. Erstmal angewendet wurde die Jejunum-Interposition 1935[12] durch den Japaner T. Seo.
Dünndarmschlinge mit Ersatzmagenbildung (Ösophagojejunostomie)
Analog dem Vorgehen bei der Billroth-II-Resektion kann eine Jejunumschlinge am Ösophagus anastomosiert werden. Durch eine lange Seit-zu-Seit-Anastomose dieser Schlinge dicht unterhalb der Ösophagojejunostomie kommt eine Art Reservoir zustande im Sinne eines Ersatzmagens. Auch hier wird eine Braunsche Fußpunktanastomose angelegt. Der Duodenalstumpf wird blind verschlossen.
Einfache Dünndarmschlinge
Hier wird das obere Jejunum an einer geeigneten Stelle durchtrennt. Die distale, abführende Schlinge wird zum Ösophagus hochgezogen und mit diesem – mit oder ohne Jejunoplicatio – anastomosiert. Das Ende der zuführenden Schlinge wird End-zu-Seit mit der abführenden Schlinge verbunden (Roux-Y-Anastomose). Der Duodenalstumpf wird ebenfalls blind verschlossen.
Risiken und Komplikationen
Während die Mortalität des Eingriffs ursprünglich etwa 50 % betrug, wurde bis 1955 eine Senkung auf unter 5 % erreicht.[13] Unspezifische Operationsrisiken sind intra- und postoperative Blutung (Blutkonserven müssen bereitgehalten werden), Wundheilungsstörungen, Entstehung von Narbenbrüchen (Hernien), Thrombose, Lungenembolie und postoperative Lungenentzündung.
Spezifische Risiken sind Verletzungen der Gallenwege, der Leber, der Milz (falls nicht ohnehin entfernt) und der linken Niere. Die Gefahr einer Anastomoseninsuffizienz ist besonders an der Ösophagusanastomose relativ hoch und kann nur durch genaueste Beachtung der Durchblutung und absolute Spannungsfreiheit vermieden werden. Außer einer Peritonitis droht hier ggf. auch eine mindestens ebenso gefährliche Mediastinitis, wenn die Anastomose oberhalb des Zwerchfells liegt. Die Komplikation der Anastomoseninsuffizienz ist nachgewiesenermaßen auch bakteriell bedingt und kann durch eine lokale antimikrobielle Prophylaxe (Dekontamination) vermieden werden.[14][15][16]
Spätkomplikationen, auch agastrisches Syndrom genannt, sind zum einen die perniziöse Anämie aufgrund des Fehlens von Vitamin B12, welches nur durch den in der Magenschleimhaut gebildeten intrinsischen Faktor aufgenommen werden kann. Zur Prophylaxe muss alle drei Monate Vitamin B12 injiziert werden, da es peroral durch den fehlenden Magen nicht mehr verwertet werden kann. Zum anderen kann es zur Ausbildung eines Dumping-Syndroms durch Wegfall der Reservoirfunktion des Magens bei Aufnahme großer kohlenhydratreicher Nahrungsmengen kommen. Beim Frühdumping entziehen die im Dünndarm befindlichen Kohlenhydrate dem Gefäßsystem Wasser, was zusammen mit einer Stimulation des Parasympathikus zu einem Blutdruckabfall, bis hin zum Volumenmangelschock führen kann. Das Spätdumping entsteht dagegen ca. 2 Stunden nach Nahrungsaufnahme durch überschießende Insulinsekretion, was zu Herzrasen und Hypoglykämie führt. Meistens verschwinden die Beschwerden mit der Zeit durch Gewöhnung und Anpassung der Ernährungsgewohnheiten.
Literatur
- Rudolf Häring, H. Franke: Gastrektomie und Kardiaresektion beim Magenkarzinom. Thieme, Stuttgart 1970.
- J. C. Hemmeter: The first complete removal of the human stomach in America. Probably also the first total gastrectomy in the world. In: New York Medical Record. 1898, S. 409 ff.
- S. Kitano, H.-K. Yang: Laparoscopic Gastrectomy for Cancer. Springer, 2012, ISBN 978-4-431-54002-1.
- Franz X. Sailer: Die totale Magenresektion. In: Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Hrsg. von Franz X. Sailer und Friedrich W. Gierhake, Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 58–60.
- J. R. Siewert, A. H. Hölscher, J. Lange et al.: Eingriffe beim Magenkarzinom. In: Breitner (Hrsg.): F. Gschnitzer et al., Chirurgische Operationslehre. Band IV: Chirurgie des Abdomens 2. 2. Auflage. Verlag Urban & Schwarzenberg, München / Wien / Baltimore 1989, ISBN 3-541-14442-4.
- E. Uhlhorn: Totale Exstirpation des Magens. In: Archiv für Klinische Chirurgie. Band 144, 1927, S. 593 ff.
Weblinks
Einzelnachweise
- Phineas Sanborn Connor: Society proceedings: Cancer of the stomach, gastrostomy, gastroenterostomy. In: Med. News (Philadelphia), Band 45, 1884, S. 576–580.
- P. S. Connor: Report of a case of complete resection of the stomach. In: Med. News (N. Y.). Badn 45, 1884, S. 578 ff.
- Barbara I. Tshisuaka: Péan, Jules Emile. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1119.
- Franz X. Sailer: Die totale Magenresektion. In: Chirurgie historisch gesehen: Anfang – Entwicklung – Differenzierung. Hrsg. von Franz X. Sailer und Friedrich W. Gierhake, Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 58–60.
- Carl Schlatter: Über Ernährung und Verdauung nach vollständiger Entfernung des Magens – Oesophagoenterostomie – beim Menschen. In: Bruns’ Beiträge zur klinischen Chirurgie. Band 19, 1897, S. 757–776.
- C. B. Brigham: Case of removal of the entire stomach for carcinoma: Successful esophago-duodenostomy: Recovery. In: Boston med. surg. J. 138/18, 1898, S. 415–419.
- Max Raab, Federico Gutiérrez: Übersicht über die Entwicklung des Magenersatzes nach Gastrektomie. In: Würzburger medizinhistorische Mitteilungen. Band 5, 1987, S. 271–310, hier: S. 272 f.
- Vgl. auch S. D. Wilson, Edwin Homer Ellison: Survival in patients with the Zollinger-Ellison-syndrome treated by total gastrectomy. In: American Journal of Surgery. Band 111, 1966, S. 787 ff.
- Vgl. etwa V. Hoffmann: Eine Methode des „plastischen Magenersatzes“. In: Zentralblatt für Chirurgie. Band 50, 1923, S. 633 ff.
- Vgl. etwa A. J. Hunnicut: Replacing Stomach After Total Gastrectomy with Right Ieocolon. In: Archiv of Surgery. Band 65, 1952, S. 1 ff.
- Max Raab, Federico Gutiérrez: Übersicht über die Entwicklung des Magenersatzes nach Gastrektomie. In: Würzburger medizinhistorische Mitteilungen. Band 5, 1987, S. 271–310.
- Max Raab, Federico Gutiérrez: Übersicht über die Entwicklung des Magenersatzes nach Gastrektomie. In: Würzburger medizinhistorische Mitteilungen. Band 5, 1987, S. 271–310, hier: S. 291.
- K. Nakayma: Die Beurteilung verschiedener operativer Methoden für die totale Gastrektomie. In: Der Chirurg. Band 26, 1955, S. 266 ff.
- HM Schardey, T Kamps, HG Rau, S Gatermann, G Baretton, FW. Schildberg: Bacteria: a major pathogenic factor for anastomotic insufficiency. In: Antimicrob Agents Chemother. 1994 Nov; 38(11), S. 2564–2567.
- HM Schardey, U Joosten, U Finke, KH Staubach, R Schauer, A Heiss, A Koistra, HG Rau, R Nibler, S Lüdeling, K Unertl, G Ruckdeschel, H Exner, FW. Schildberg: The prevention of anastomotic leakage after total gastrectomy with local decontamination. A prospective, randomized, double-blind, placebo-controlled multi center trial. In: Ann Surg 1997 Feb; 225(2), S. 172–180.
- AD Olivas, BD Shogan, V Valuckaite, A Zaborin, N Belogortseva, M Musch, F Meyer, WL Trimble, G An, J Gilbert, O Zaborina, JC. Alvery: Intestinal tissues induce an SNP mutation in Pseudomonas aeruginosa that enhances its virulence: possible role in anastomotic leak. In: PLOS ONE 2012; 7(8), S. e44326, doi:10.1371/journal.pone.0044326