Furfurylalkohol
Furfurylalkohol ist eine chemische Verbindung aus der Gruppe der Alkohole und substituierten Sauerstoffheterocyclen. Sie leitet sich vom Furan ab und unterscheidet sich von diesem durch eine zusätzliche Hydroxymethylgruppe.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
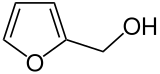 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Furfurylalkohol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H6O2 | |||||||||||||||
| Kurzbeschreibung |
farblose, fast geruchlose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 98,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,13 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
171 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | |||||||||||||||
| Brechungsindex |
1,487 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 10 ml·m−3 bzw. 40 mg·m−3[4] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung

Industriell wird Furfurylalkohol durch katalytische Reduktion aus Furfural gewonnen. Da Furfural aus hemicellulosereichen landwirtschaftlichen Reststoffen, wie etwa Maisspindeln (englisch corn cob) oder Bagasse, gewonnen wird, wird auch Furfurylalkohol vollständig aus nachwachsenden Rohstoffen hergestellt.[5] Es kann also vollständig aus nachwachsenden Rohstoffen hergestellt werden.
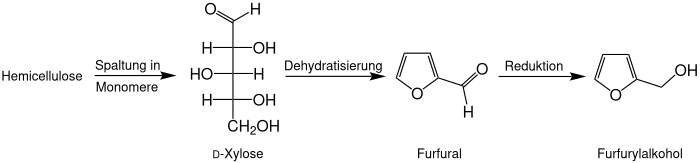
Furfurylalkohol kann auch mittels einer Cannizzaro-Reaktion durch Disproportionierung von Furfural hergestellt werden, wobei auch 2-Furancarbonsäure entsteht.[6]
Eigenschaften
Physikalische Eigenschaften
Furfurylalkohol ist eine farblose bis klar-gelbe Flüssigkeit mit schwach stechendem Geruch. Bei einem Kontakt mit Luft oder Licht verfärbt sich die Verbindung braun bis rotbraun. Sie ist gut löslich in vielen organischen Lösungsmitteln (z. B. Ethanol, Diethylether), löslich in Chloroform.[7]
Chemische Eigenschaften
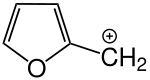
Die Verbindung ist vielfältig reaktionsfähig. Im sauren Medium können mesomeriestabilisierte Carbeniumionen gebildet werden. Diese sind Ausgangspunkt für Kondensationsreaktionen, bei denen unterschiedlich verknüpfte und unterschiedlich lange lineare Oligomere entstehen (Furanharze).[5] Überwiegend sind die Furanringe über Methylengruppen (–CH2–) verknüpft, daneben gibt es allerdings auch Verknüpfungen über Dimethylenethergruppen (–CH2–O–CH2–).[8][9][10][11] Besonders unter stark sauren Bedingungen wird aus diesen jedoch Formaldehyd abgespalten und es entstehen wiederum Methylengruppen.[10][11]
Sicherheitstechnische Kenngrößen
Furfurylalkohol bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 75 °C. Der Explosionsbereich liegt zwischen 1,8 Vol.‑% (70 g/m3) als untere Explosionsgrenze (UEG) und 16,3 Vol.‑% (670 g/m3) als obere Explosionsgrenze (OEG).[1] Der eine untere Explosionspunkt beträgt 70 °C.[1] Die Grenzspaltweite wurde mit 0,8 mm bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[1] Die Zündtemperatur beträgt 390 °C.[1] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung

Furfurylalkohol wird hauptsächlich zur Herstellung von Furanharzen genutzt, welche vielfältige Anwendungsmöglichkeiten haben.[9] Weiterhin dient es als Lösungsmittel und Reaktivverdünner in anderen Harzen[5] und wird in Netzmitteln[6] genutzt. Neuerdings wird es auch in der chemischen Holzmodifikation bei der Herstellung von furfuryliertem Holz verwendet.[6]
Risikobewertung
Die Internationale Agentur für Krebsforschung (IARC) stufte Furfurylalkohol im Jahr 2017 als möglicherweise krebserzeugend ein.[12]
Furfurylalkohol wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Furfurylalkohol war die Besorgnis bezüglich der Einstufung als CMR-Stoff, Verbraucherverwendung, Umweltexposition, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung. Die Neubewertung fand ab 2013 statt und wurde von Polen durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[13][14]
Siehe auch
Weblinks
- Joint FAO/WHO Expert Committee on Food Additives (JECFA), Monograph für Furfuryl Alcohol and Related Substances
Einzelnachweise
- Eintrag zu Furfurylalkohol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. März 2024. (JavaScript erforderlich)
- Gerhard W. Becker, Dietrich Braun, Wilbrand Woebcken; Kunststoffhandbuch 11 Bde. in 17 Tl.-Bdn., Bd. 10, Duroplaste: BD 10; ISBN 3-446-14418-8.
- Eintrag zu Furfuryl alcohol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 98-00-0 bzw. Furfurylalkohol), abgerufen am 2. November 2015.
- Oliver Türk: Stoffliche Nutzung nachwachsender Rohstoffe. Springer Vieweg, Wiesbaden, 2014, ISBN 978-3-8348-1763-1, S. 443–454.
- Eintrag zu Furfurylalkohol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Januar 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-266.
- J. B. Barr & S. B. Wallon: The Chemistry of Furfuryl Alcohol Resins. In: Journal of Applied Polymer Science. Band 15, 1971, S. 1079–1090, doi:10.1002/app.1971.070150504.
- R. H. Kottke: Furan Derivates. In: Encyclopedia of chemical technology. Raymond Eller Kirk & Donald Frederick Othmer, 4. Dezember 2000, abgerufen am 16. August 2019.
- Alessandro Gandini & Mohamend Naceur Belgacem: Furans. In: Hanna Dodiuk & Sidney H. Goodman (Hrsg.): Handbook of Thermoset Plastics. Elsevier, Amsterdam 2014, ISBN 978-1-4557-3107-7, S. 93–110.
- Alessandro Gandini & Mohamend Naceur Belgacem: Furans in Polymer Chemistry. In: Progress in Polymer Science. Band 22, Nr. 6, 1997, S. 1203–1379, doi:10.1016/S0079-6700(97)00004-X.
- Yann Grosse, Dana Loomis, Kathryn Z Guyton, Fatiha El Ghissassi, Véronique Bouvard, Lamia Benbrahim-Tallaa, Heidi Mattock, Kurt Straif: Some chemicals that cause tumours of the urinary tract in rodents. In: The Lancet Oncology. 18, 2017, S. 1003–1004, doi:10.1016/S1470-2045(17)30505-3.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Furfuryl alcohol, abgerufen am 26. März 2019.

