2′-Fucosyllactose
2′-Fucosyllactose ist ein Trisaccharid, das in den 1950er Jahren in Muttermilch gefunden wurde. Es ist somit ein Humanes Milch-Oligosaccharid (HMO). Die heute am weitesten verbreitete Isolationsmethode wird seit 1972 eingesetzt.[3] Weiterhin kommt es auch in Kot vor.[2] Sie wirkt äquivalent zur 3′-Fucosyllactose.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
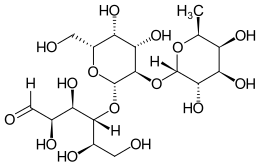 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2′-Fucosyllactose | |||||||||||||||
| Andere Namen |
(2R,3R,4R,5R)-4-[(2S,3R,4S,5R,6R)-4,5-dihydroxy-6-(hydroxymethyl)-3-[(2S,3S,4R,5S,6S)-3,4,5-trihydroxy-6-methyloxan-2-yl]oxyoxan-2-yl]oxy-2,3,5,6-tetrahydroxyhexanal | |||||||||||||||
| Summenformel | C18H32O15 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 488,44 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,548 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
leicht in Wasser (240 g·l−1 bei 25 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Isolation
Diese Substanz kann in größeren Mengen durch E. coli erzeugt werden.[5]
Die Isolation erfolgt wie bei anderen HMO. Hierzu werden zunächst die Fette, Proteine und der Großteil der Lactose abgespalten und nach einer Filtration mit einem Sephadex Gel wird eine Papierchromatographie durchgeführt. Manchmal ist auch eine Elektrophorese erforderlich.[6] inzwischen werden aber auch enzymatische Ansätze zur Synthese von 2'-Fucosyllactose eingesetzt.[7]
Verwendung
Wie andere Oligosaccharide hat 2′-Fucosyllactose die Fähigkeit gegen Infektionskrankheiten zu schützen, indem sie die Anhaftung von Toxinen und Krankheitserregern an das Epithel verhindert.[8][9] Es ist bekannt, dass 2′-Fucosyllactose unter anderem gegen Campylobacter jejuni, Salmonella enterica Serotyp Typhimurium und Helicobacter pylori schützt.[8] In den USA ist es von der FDA für die Verwendung in Babynahrung bei einer Konzentration von höchstens 2 g/l zugelassen.[10] Es wurde auch in Assays für Glycosyltransferasen in den Blutgruppen A und B verwendet.[11]
Einzelnachweise
- Datenblatt 2′-Fucosyllactose bei Sigma-Aldrich, abgerufen am 24. Januar 2022 (PDF).
- Eintrag zu 2-Fucosyllactose in der Human Metabolome Database (HMDB), abgerufen am 11. Mai 2018.
- A. Anderson, A. S. Donald: Improved method for the isolation of 2′ fucosyllactose from human milk. In: Journal of Chromatography A. Band 211, Nr. 1, 26. Juni 1981, S. 170–174, PMID 6894927.
- Jennewein Biotechnoliogie GmbH: Fucosyllactose - Jennewein Biotechnologie GmbH. In: Jennewein Biotechnologie GmbH. (jennewein-biotech.de [abgerufen am 13. Mai 2018]).
- Young-Wook Chin, Ji-Yeong Kim, Won-Heong Lee, Jin-Ho Seo: Enhanced production of 2′-fucosyllactose in engineered Escherichia coli BL21star(DE3) by modulation of lactose metabolism and fucosyltransferase. In: Journal of Biotechnology. Band 210, September 2015, S. 107–115, doi:10.1016/j.jbiotec.2015.06.431.
- Akira Kobata: [24] Isolation of oligosaccharides from human milk. In: Methods in Enzymology. Elsevier, 1972, ISBN 978-0-12-181891-3, S. 262–271, doi:10.1016/0076-6879(72)28026-0.
- Christoph Albermann, Wolfgang Piepersberg, Udo F Wehmeier: Synthesis of the milk oligosaccharide 2′-fucosyllactose using recombinant bacterial enzymes. In: Carbohydrate Research. Band 334, Nr. 2, August 2001, S. 97–103, doi:10.1016/s0008-6215(01)00177-x.
- Won-Heong Lee, Panchalee Pathanibul, Josh Quarterman, Jung-Hyun Jo, Nam Soo Han: Whole cell biosynthesis of a functional oligosaccharide, 2′-fucosyllactose, using engineered Escherichia coli. In: Microbial Cell Factories. Band 11, 30. April 2012, S. 48, doi:10.1186/1475-2859-11-48, PMID 22545760, PMC 3442965 (freier Volltext).
- D TAYLOR, D RASKO, R SHERBURNE, C HO, L JEWELL: Lack of correlation between Lewis antigen expression by and gastric epithelial cells in infected patients. In: Gastroenterology. Band 115, Nr. 5, November 1998, S. 1113–1122, doi:10.1016/s0016-5085(98)70082-4.
- GRAS Notices. Abgerufen am 11. Mai 2018.
- E. Dejana, A. Bonaccorsi, G. de Gaetano: Acetylsalicylic acid and the cardiovascular effects of ADP in the rat. In: Haemostasis. Band 7, Nr. 5, 1978, S. 294–297, doi:10.1159/000214271, PMID 689492.