Formanilid
Formanilid ist eine chemische Verbindung aus der Gruppe der Carbonsäureamide.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
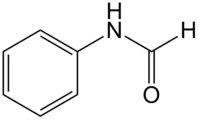 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Formanilid | ||||||||||||||||||
| Andere Namen |
N-Phenylformamid | ||||||||||||||||||
| Summenformel | C7H7NO | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 121,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,144 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
271 °C[1] | ||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (25,4 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Formanilid kann durch rasches Destillieren von Anilin und Oxalsäure gewonnen werden.[2] Es kann auch durch Reaktion von Anilin mit Pentafluorphenylformat oder durch Reaktion von Arylaziden mit dem Enolat von Acetaldehyd dargestellt werden.[3]
Eigenschaften
Formanilid ist ein brennbarer schwer entzündbarer, kristalliner, weißer Feststoff, der wenig löslich in Wasser ist.[1] Die Verbindung kommt bei Raumtemperatur in zwei isomeren Formen (cis- und trans-) vor, die im NMR-Spektrum unterschieden werden können. Grund: Die Amidbindung (genauer: die C-N-Bindung des Carbonsäureamids) ist mesomeriestabilisiert – besitzt also einen partiellen Doppelbindungscharakter – und ist daher nicht frei drehbar.[4][5]
Verwendung
Formanilid wird als Zwischenprodukt zur Herstellung anderer chemischer Verbindungen (zum Beispiel von Mepanipyrim[6]) verwendet.[7]
Einzelnachweise
- Eintrag zu Formanilid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. November 2018. (JavaScript erforderlich)
- H. Altenburg, I. Bang, K. Bartelt, Fr. Baum, C. Brahm, W. Cramer, K. Dieterich, R. Ditmar, M. Dohrn, H. Einbeck, H. Euler, E. St. Faust, C. Funk, O. v. Fürth, O. Gerngross, V. Grafe, O. Hesse, K. Kautzsch, Fr. Knoop, R. Kobert, R. Leimbach, J. Lundberg, O. Neubauer, C. Neuberg, M. Nierenstein, O. A. Oesterle, Th. B. Osborne, L. Pincussohn, H. Pringsheim, K. Raske, B. v. Reibold, Br. Rewald, A. Rollett, P. Rona, H. Rupe, Fr. Samuely, H. Scheibler, J. Schmid, J. Schmidt, E. Schmitz, M. Siegfried, E. Strauss, A. Thiele, G. Trier, W. Weichardt, R. Willstätter, A. Windaus, E. Winterstein, E. Witte, G. Zemplén, E. Zunz, Emil Abderhalden: Biochemisches Handlexikon I. Band, 2. Hälfte. Springer-Verlag, 2013, ISBN 978-3-642-51421-0, S. 921 (eingeschränkte Vorschau in der Google-Buchsuche).
- Malcolm Sainsbury: Aromatic Compounds A Modern Comprehensive Treatise. Elsevier, 1995, ISBN 0-08-088098-3, S. 84 (eingeschränkte Vorschau in der Google-Buchsuche).
- A.J.R. Bourn, D.G. Gillies, E.W. Randall: Cis-trans isomerism in formanilide. In: Tetrahedron. 20, 1964, S. 1811, doi:10.1016/S0040-4020(01)98450-9.
- Ilya I. Marochkin, Olga V. Dorofeeva: Molecular structure and relative stability of trans and cis isomers of formanilide: gas-phase electron diffraction and quantum chemical studies. In: Structural Chemistry. 24, 2013, S. 233–242, doi:10.1007/s11224-012-0071-6.
- Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 978-0-8155-1853-2, S. 559 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eberhard Breitmaier, Günther Jung: Organische Chemie Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen ; 129 Tabellen. Georg Thieme Verlag, 2005, ISBN 978-3-13-541505-5, S. 313 (eingeschränkte Vorschau in der Google-Buchsuche).