Flusssäure
Flusssäure, auch Fluorwasserstoffsäure genannt (zur Namensgebung siehe Fluorit), ist die wässrige Lösung von Fluorwasserstoff (HF). Flusssäure ist eine farblose, stechend riechende, hochgiftige Flüssigkeit. Sie greift selbst Glas stark an und wirkt stark ätzend auf die Haut, die Schleimhäute und die Bindehaut der Augen, wobei schon eine geringe Exposition (bspw. durch dermale Aufnahme) schnell zum Tod führen kann. Eine Lösung von 38,2 % HF in Wasser bildet ein azeotrop siedendes Gemisch mit einem Siedepunkt von 112 °C. Flusssäure wird, abhängig von der Konzentration, entweder in Behältern aus Kunststoff oder aus rostfreiem Stahl aufbewahrt.
| Allgemeines | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Name | Flusssäure | |||||||||
| Andere Namen |
Fluorwasserstoffsäure | |||||||||
| Summenformel | HF (aq) | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 20,01 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Dichte |
1,14 g·cm−3 (38 %, Azeotrop)[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
112 °C (38 %)[2] | |||||||||
| Löslichkeit |
mischbar mit Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
1 ml·m−3[1] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Herstellung
Getrocknetes Fluoritpulver und Schwefelsäure werden zur Reaktion in den Drehrohrofen gegeben. Die Temperatur der Ofengasphase wird auf etwa 280 °C geregelt. Das Nachreaktionsgas tritt in den Rohdestillationsturm ein, um den größten Teil der Schwefelsäure, des Wassers und des Fluoritpulvers zu entfernen. Die Temperatur des Turmkessels wird auf 100 bis 110 °C geregelt und die Kopftemperatur beträgt 35 bis 40 °C. Das rohe Fluorwasserstoffgas wird durch einen Entgasungsturm weiter in einen flüssigen Zustand kondensiert und tritt dann in den Rektifikationsturm zur Rektifikation ein. Der gereinigte Fluorwasserstoff wird von Wasser absorbiert, so dass Flusssäure erhalten wird. Die Reaktionsgleichungen lauten:
Das Nebenprodukt Fluoroanhydrit findet in der Baustoffindustrie Verwendung.
Flusssäure fällt auch bei der Produktion von Phosphorsäure aus Fluorapatit an, wobei der Reaktionsgang analog zum oben dargestellten ist, jedoch unter Beteiligung von Phosphat. Der hierbei analog anfallende Phosphorgips ist jedoch zumeist zu verunreinigt, um wirtschaftlich nutzbar zu sein.
Eigenschaften
Fluorwasserstoff ist im Vergleich zu den anderen Halogenwasserstoffen eine schwache Säure (pKs = 3,14). Flusssäure greift Gold und Platin nicht an, jedoch werden Tantal, Silber, Kupfer und Blei schwach angegriffen. Flusssäure ist die einzige Säure, die Quarz unter Bildung von Siliciumtetrafluorid oder Hexafluoridokieselsäure aufzulösen vermag.
Verwendung
Für Flusssäure gibt es zahlreiche Verwendungszwecke in Industrie und Wissenschaft. Die industrielle Gesamtproduktion in Europa betrug im Jahre 2015 über 230.000 Tonnen. Diese wurden in neun Produktionsstätten hergestellt. Fünf davon stehen in Deutschland.[5]
Industrielle Verwendung
- Fluorchlorkohlenwasserstoffe (FCKW) werden vor allem in der Kältetechnik und zur Verschäumung von Kunststoffen benutzt.
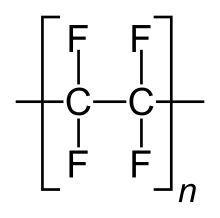 Strukturformel von Polytetrafluorethylen (Teflon)
Strukturformel von Polytetrafluorethylen (Teflon) - 60 % der Flusssäure werden für die Herstellung von Fluorkohlenstoffen (FK) benötigt.[5]
- Fluorpolymere sind Kunststoffe, die sich durch ihre besondere Stabilität auszeichnen. Der bekannteste davon ist PTFE (Teflon).
- Metallgewinnung und -verarbeitung. Flusssäure ist dort z. B. ein Reaktionsprodukt, um Aluminiumfluorid herzustellen oder wird bei der Gewinnung seltener Metalle wie Niob oder Tantal und bei der Oberflächenbehandlung von rostfreiem Edelstahl eingesetzt.
- Ansonsten kommt Flusssäure in der Erdölindustrie als Katalysator, in geringen Maße in der Arzneimittel- und Pflanzenschutzmittelherstellung, zum Einsatz.
- Darüber hinaus wird die glasätzende Wirkung bei der Herstellung von Kristallglas zur Oberflächenpolierung genutzt.
Forschung und Wissenschaft

In der Forschung ist Flusssäure unter anderem ein Ätzmittel für Siliciumdioxid, Titan, Niob, Tantal[6] oder Wolfram, z. B. in der Mikrostrukturierung von Oberflächen. Dort wird häufig eine mit Ammoniumfluorid gepufferte Flusssäure verwendet, um den Ablauf des Ätzprozess besser steuern zu können.[7] Daneben wird die Fähigkeit Silicate zu lösen bei Aufschlussverfahren in der Analytik eingesetzt.
In der Paläontologie und Pollenkunde wird HF zum Freilegen von unempfindlichen Fossilien oder von Exinen benutzt.
Sonstige Verwendung
Eine 10 % wässrige Fluorwasserstofflösung findet Verwendung als Rostentferner für Textilien.[8]
Flusssäure wird auch zum „Etching“, dem Zerkratzen von Glasscheiben, häufig an Einrichtungen des Öffentlichen Personenverkehrs, verwendet (siehe dazu auch Scratching). Dabei kann es zu schweren Verletzungen der Haut und der Atemwege kommen, wenn Fahrgäste oder das Reinigungspersonal mit der Flüssigkeit in Berührung kommen.[9]
Durch die Populärkultur, wie der US-Fernsehserie Breaking Bad, erlangte Fluorwasserstoffsäure zusätzliche Berühmtheit. Der Mythos, dass diese mühelos Leichen zersetzen kann, gilt allerdings als widerlegt.[10]
Toxikologie

Flusssäure zeigt, je nach Exposition, nur lokale oder auch systemische Wirkung. Bei Konzentrationen über etwa 50 % treten Verätzungen des Gewebes auf. Aber auch niedrigere Konzentrationen können schwere Gewebeschäden verursachen. Da Flusssäure lipophil ist, kann sie die Haut durchdringen. In der Tiefe des Gewebes bildet es schwer lösliches Calcium- und Magnesiumfluorid, die dadurch verursachte Störung des Elektrolythaushaltes schädigt Zellen und führt zu starken Schmerzen. Bei starker Exposition (Konzentration über 50 %, Exposition von mehr als 5 % der Körperoberfläche), Einatmen oder Verschlucken führt diese Störung auch zu systemischen Effekten wie Übelkeit, Erbrechen, Krämpfen, niedrigem Blutdruck, Herzrhythmusstörungen bis zu Herzstillstand. Die Symptome können insbesondere bei Kontakt mit niedrigkonzentrierter Flusssäure erst etliche Stunden später auftreten. Es wird davon ausgegangen, dass Fluorid-Ionen auch direkt toxisch für Herzmuskelzellen sind.
Aufgrund der Seltenheit von Unfällen mit Flusssäure fehlen große systematische Untersuchungen zur Behandlung. Bei Kontakt mit der Haut sollte diese gründlich mit Wasser gespült und anschließend mit Calciumgluconatgel eingerieben werden. Eine Unterspritzung mit Calciumgluconatlösung ist in der Literatur umstritten, ebenso die intraarterielle Gabe von Calciumgluconat zur Neutralisation der Flusssäure. Bei starker Exposition kann die chirurgische Entfernung des Gewebes notwendig sein. Bei Augenverletzungen hilft nur langes Spülen mit Wasser, auf keinen Fall darf Calciumgluconat angewendet werden.[11] Bei Inhalation soll Sauerstoff und vernebelte Calciumgluconatlösung gegeben werden.[12] Systemische Störungen des Elektrolythaushalts werden durch Infusionen mit Calciumgluconatlösung sowie Dialyse behandelt.[13]
Weblinks
- Literatur von und über Flusssäure im Katalog der Deutschen Nationalbibliothek
- Schweizerisches Toxikologisches Informationszentrum: Verätzungen und Vergiftungen durch Flusssäure
Einzelnachweise
- Eintrag zu Fluorwasserstoffsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 449.
- Datenblatt Flusssäure bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Hydrogen fluoride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Ein Überblick über die Fluorchemie. (PDF; 3,3 MB) 4. Ausgabe. Eurofluor, Dezember 2019, abgerufen am 23. Februar 2020.
- Patent DE10259934: Verfahren zur Herstellung von Formteilen aus Niob oder Tantal durch elektrochemisches Ätzen und so erhältliche Formteile. Veröffentlicht am 20. Dezember 2002, Erfinder: Marianne Gottschling, Josua Löffelholz, Mathias Albert, Günter Sadowski.
- Buffered HF (BOE). In: microchemicals.com. Abgerufen am 23. Februar 2020 (englisch).
- BURNUS Rostentferner. (PDF) Produktbeschreibung. burnusHYCHEM GmbH, August 2007, archiviert vom (nicht mehr online verfügbar) am 18. Oktober 2018; abgerufen am 18. Oktober 2018.
- Polizeieinsatz in Berlin: Labor bestätigt Verdacht auf Flusssäure bei Spiegel Online, abgerufen am 29. Januar 2013.
- 'MythBusters' proves 'Breaking Bad's' Walt needs some more schooling. Abgerufen am 17. Juni 2020 (englisch).
- Vorsicht – Lebensgefahr! Echt ätzend! Abgerufen am 25. Juli 2023.
- GUIDELINES IN CASE OF EXPOSURE WITH HYDROGEN FLUORIDE (AHF) AND HYDROFLUORIC ACID (HF) EUROFLUOR (European Technical Committee for Fluorine). Abgerufen am 24. November 2022.
- Daniel McKee, Achilleas Thoma, Kristy Bailey, Joel Fish: A review of hydrofluoric acid burn management. In: Plastic Surgery. Band 22, Nr. 2, 2014, S. 95–98, PMID 25114621, PMC 4116323 (freier Volltext).

