Flavanonole
Die Flavanonole (Syn: Dihydroflavonole) sind eine Untergruppe sekundärer Pflanzenstoffe innerhalb der Stoffgruppe der Flavonoide. Sie unterscheiden sich strukturell von dem ihnen zugrunde liegenden Flavan durch eine zusätzliche Hydroxygruppe in Position 3 und eine zusätzliche Ketogruppe in Position 4. Das Grundgerüst der Flavanonole ist somit die Verbindung 3-Hydroxyflavan-4-on.

Struktur
Wie die Flavanole und die Leukoanthocyanidine besitzen die Flavanonole zwei Chiralitätszentren an den Kohlenstoffatomen C2 und C3, so dass es zu einer Konstitutionsformel immer jeweils vier mögliche Konfigurationen gibt: (2R,3R), (2S,3S), (2R,3S) und (2S,3R).[1] Dabei ist bei den Flavanonolen die (2R,3R)-Konfiguration bei weitem die gängigste Konfiguration, aber es gibt Flavanonol-Typen wie beispielsweise die Glycoside Astilbin und Engeletin, für die alle vier möglichen Konfigurationen gefunden wurden.[1][2]
Die einzelnen Flavanonole unterscheiden sich voneinander durch das Substitutionsmuster des 3-Hydroxyflavan-4-on-Grundgerüsts mit Hydroxygruppen und durch die Art der weiteren Derivatisierung dieser hydroxylierten 3-Hydroxyflavan-4-one durch u. a. O-Alkylierung, meist in der Form von O-Methylierung und/oder durch die O-glycosidische Anbindung von Saccharid-Resten unter Bildung von Glycosiden. Weitere Derivatisierungsarten sind C-Alkylierung, Acylierung und die C-glycosidische Anbindung von Saccharid-Resten.[1][3][4]
Nicht-glycosylierte Flavanonole
Die häufigsten Flavanonole sind Aromadendrin, Taxifolin und Ampelopsin. Typisch für die gängigen Flavanonole ist, dass neben der Position 3 am C-Ring auch die Positionen 5 und 7 am A-Ring Hydroxygruppen tragen. Bzgl. der Substitution des B-Rings ist die Hydroxylierung der Positionen 4' (Aromadendrin), 3' und 4' (Taxifolin) bzw. 3', 4' und 5' (Ampelopsin) auch bei anderen Untergruppen der Favonoide gängig.
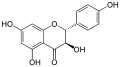 Aromadendrin
Aromadendrin-Taxifolin.svg.png.webp) Taxifolin
Taxifolin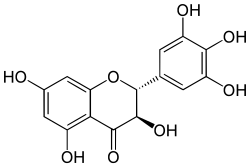 Ampelopsin
Ampelopsin
Auch die analogen Flavanonole ohne Hydroxygruppe am Kohlenstoffatom in Position 5 des A-Rings sind bekannt. Diese sind Garbanzol, Fustin und (+)-Dihydrorobinetin.[1]
Von der zu Taxifolin isomeren Verbindung Dihydromorin wurden eine ganze Anzahl von C-alkylierten Derivaten gefunden. Beispielsweise sind bei Kushenol L Prenylreste an die Kohlenstoffatome in den Positionen 6 und 8 gebunden.[4]
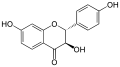 Garbanzol
Garbanzol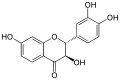 Fustin
Fustin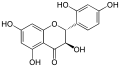 Dihydromorin
Dihydromorin
| Name | Synonym | CAS | Konfig. C2, C3 | 3 | 5 | 6 | 7 | 8 | 2′ | 3′ | 4′ | 5′ | 6′ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampelopsin | (+)-Dihydromyricetin | 27200-12-0 | (2R,3R) | OH | OH | H | OH | H | H | OH | OH | OH | H |
| Aromadendrin | (+)-Dihydrokaempferol | 480-20-6 | (2R,3R) | OH | OH | H | OH | H | H | H | OH | H | H |
| Dihydromorin | 18422-83-8 | (2R,3R) | OH | OH | H | OH | H | OH | H | OH | H | H | |
| (+)-Dihydrorobinetin | (+)-5-Deoxydihydromyricetin | 4382-33-6 | (2R,3R) | OH | H | H | OH | H | H | OH | OH | OH | H |
| Fustin | Dihydrofisetin | (2R,3R) | OH | H | H | OH | H | H | OH | OH | H | H | |
| 8-Hydroxyfustin | OH | H | H | OH | OH | H | OH | OH | H | H | |||
| Garbanzol | (2R,3R)-5-Deoxy-dihydrokaempferol | 1226-22-8 | (2R,3R) | OH | H | H | OH | H | H | H | OH | H | H |
| Kushenol L | (2R,3R)-6,8-Diprenyldihydromorin | 101236-50-4 | (2R,3R) | OH | OH | Prenyl | OH | Prenyl | OH | H | OH | H | H |
| Pinobanksin | (2R,3R)-Dihydrogalangin | 548-82-3 | (2R,3R) | OH | OH | H | OH | H | H | H | H | H | H |
| Taxifolin | (+)-Dihydroquercetin | 480-18-2 | (2R,3R) | OH | OH | H | OH | H | H | OH | OH | H | H |
| 3'-O-Methyltaxifolin | (+)-Dihydroisorhamnetin | 55812-91-4 | (2R,3R) | OH | OH | H | OH | H | H | OMe | OH | H | H |
Glycosylierte Flavanonole
| Glycosid | Aglycon | CAS | Konfig. C2, C3 | 3 | 5 | 6 | 7 | 8 | 2′ | 3′ | 4′ | 5′ | 6′ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Astilbin | (2R,3R)-Dihydroquercetin; Taxifolin | 29838-67-3 | (2R,3R) | Rha | OH | OH | OH | OH | |||||
| Neoastilbin | (2S,3S)-Dihydroquercetin | 54081-47-9 | (2S,3S) | Rha | OH | OH | OH | OH | |||||
| Isoastilbin | (2R,3S)-Dihydroquercetin | 54081-48-0 | (2R,3S) | Rha | OH | OH | OH | OH | |||||
| Neoisoastilbin | (2S,3R)-Dihydroquercetin | (2S,3R) | Rha | OH | OH | OH | OH | ||||||
| Engeletin | (2R,3R)-Dihydrokaempferol; Aromadendrin | 572-31-6 | (2R,3R) | Rha | OH | OH | OH | ||||||
| Neoengeletin | (2S,3S)-Dihydrokaempferol | 54081-49-1 | (2S,3S) | Rha | OH | OH | OH | ||||||
| Isoengeletin | (2R,3S)-Dihydrokaempferol | (2R,3S) | Rha | OH | OH | OH | |||||||
| Neoisoengeletin | (2S,3R)-Dihydrokaempferol | (2S,3R) | Rha | OH | OH | OH | |||||||
| Taxifolin-7-O-glucosid | (2R,3R)-Dihydroquercetin | (2R,3R) | OH | OH | Glc | OH | OH | ||||||
| |||||||||||||
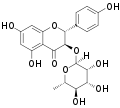 Engeletin
Engeletin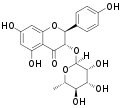 Neoengeletin
Neoengeletin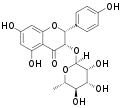 Isoengeletin
Isoengeletin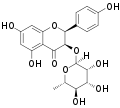 Neoisoengeletin
Neoisoengeletin
Biosynthese
Die Flavanonole werden durch Hydroxylierung der Methylengruppe in Position 3 der entsprechenden Flavanone gebildet. So entstehen aus den Flavanonen Naringenin, Eriodictyol und 3,5,7,3',4',5'-Hexahydroxyflavan-4-on die Flavanonole Aromadendrin, Taxifolin und Ampelopsin. Die Reaktion wird durch Flavanon-3-Hydroxylasen katalysiert. Die Flavanonole selbst sind Vorläufer der Flavonole, der Anthocyanidine und der Flavanole.[3][5][6]
Einzelnachweise
- Bohm B. A.: Introduction to Flavonoids - Chemistry and biochemistry of organic natural products; Volume 2, 1999, Verlag CRC Press, S. 80–82, ISBN 90-5702-353-9
- Shi, H. et al.: Separating four diastereomeric pairs of dihydroflavonol glycosides from Engelhardia roxburghiana using high performance counter-current chromatography Journal of Chromatography A, 2015, 1383, S. 79–87, doi:10.1016/j.chroma.2015.01.024
- Peter Nuhn: Naturstoffchemie. 3. Auflage. S. Hirzel, Stuttgart/Leipzig 1997, ISBN 3-7776-0613-8, S. 602–605.
- Harborne J. B.: The Flavonoids - Advances in Research since 1980, 1988, Chapman and Hall, London, New York S. 372–379, ISBN 0-412-28770-6
- Schütte, H.-R.: Secondary Plant Substances Flavonoid Biosynthesis and their Regulation, In: Ellenberg, H., Esser, K., Merxmüller, H., Schnepf, E., Ziegler, H. (eds): Fortschritte der Botanik, Progress in Botany, 1974, Vol 36. Springer, Berlin, Heidelberg, S. 108–123, ISBN 978-3-540-07036-8, doi:10.1007/978-3-662-12810-7_10
- Yu, Z. W. et al.: Exploring the genes involved in biosynthesis of dihydroquercetin and dihydromyricetin in Ampelopsis grossedentata Scientific Reports, 2021, 11(1), 15596, doi:10.1038/s41598-021-95071-x