Fidaxomicin
Fidaxomicin (Handelsname Dificlir; Pharmazeutischer Unternehmer Tillotts Pharma[3]) ist ein Arzneistoff aus der relativ neuen Gruppe der Makrozykline, der in der Behandlung von Darminfektionen mit Clostridioides difficile eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
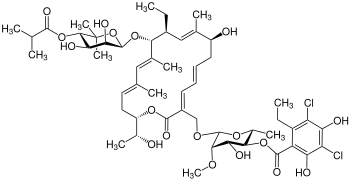 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Fidaxomicin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C52H74Cl2O18 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A07AA12 | |||||||||||||||||||||
| Wirkstoffklasse |
Makrozyklin-Antibiotika | |||||||||||||||||||||
| Wirkmechanismus |
Hemmung der bakteriellen RNA-Polymerase | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 1058,04 g·mol−1 | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Löslichkeit |
löslich in Ethanol, Methanol, DMF oder DMSO, begrenzt löslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete
Fidaxomicin ist indiziert bei Erwachsenen zur Behandlung von Darminfektionen mit den pathogenen (Toxin-bildenden) Clostridioides difficile. Die empfohlene Tagesdosis liegt bei 200 mg zweimal täglich, unabhängig von den Mahlzeiten.
Unerwünschte Wirkungen und Anwendungsbeschränkungen
Bei den beobachteten Patientengruppen zeigten sich folgende Nebenwirkungen mit folgender durchschnittlichen Häufigkeit: Erbrechen (12 von 1.000 Personen), Übelkeit (27 von 1.000 Personen) sowie Verstopfung (12 von 1.000 Personen).
Es wird angenommen, dass Fidaxomicin das P-Glykoprotein des Darmes inhibieren kann. Infolgedessen sollte die parallele Einnahme von bekannt starken P-Glykoprotein-Inhibitoren wie Ciclosporin, Clarithromycin, Verapamil, Dronedaron, Amiodaron oder Ketoconazol vermieden werden.
Anwendung bei besonderen Patientengruppen
Obwohl es bisher keine Hinweise für eine Schädigung des Fötus oder des gestillten Neugeborenen vorliegen, wird aus Sicherheitsgründen die Anwendung von Fidaxomicin während der Schwangerschaft und Stillzeit nicht empfohlen. In tierexperimentellen Studien zeigte sich Fidaxomicin als nicht teratogen.
Für Patienten, die an einem schweren Nieren- oder Leberleiden erkrankt sind, soll die Einnahme von Fidaxomicin unter genauer Beobachtung und Vorsicht erfolgen.
Pharmakologische Eigenschaften
Fidaxomicin ist ein bakterizides Makrozyklin-Antibiotikum, das biotechnisch durch den Aktinomyzeten Dactylosporangium aurantiacum spp. hamdenesis hergestellt wird. Das Makrozyklin-Antibiotikum hemmt die Proteinbiosynthese im Bakterium, indem es an die DNA-abhängige RNA-Polymerase bindet – dies passiert auch bei Rifamycinen.
Das fast wasserunlösliche Antibiotikum wird über den Darm kaum aufgenommen und wirkt somit nur lokal. Daher wird der größte Teil über den Stuhl wieder ausgeschieden. Im Darm beträgt die Halbwertszeit 8 bis 10 Stunden.
Nutzenbewertung des Gemeinsamen Bundesausschusses
Nach Beurteilung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat der Gemeinsame Bundesausschuss (G-BA) am 4. Juli 2013 einen Beschluss zum Zusatznutzen[4] gegenüber der Vergleichstherapie Vancomycin getroffen. Darin wird ein Beleg für einen Zusatznutzen bei schwer Erkrankten festgestellt. Allerdings fehlt eine geeignete Aufbereitung der Nebenwirkungen. Studien über einen Einsatz bei leicht Erkrankten wurden nicht vorgelegt.[5]
Literatur
- Fidaxomicin. In: Neue Arzneimittel. 60. Jahrgang, Mai 2013, Nr. 5.
- Johannes Hausmann, Stefan Zeuzem, Oliver Schröder: Fidaxomicin—The Next Step? A New Narrow-Spectrum Macrocyclic Antibiotic for the Management of Clostridium Difficile Infection. In: Gastroenterology. Band 141, Nr. 3, September 2011, S. 1116–1118, doi:10.1053/j.gastro.2011.07.014, PMID 21801724.
- Derrick W. Crook u. a.: Fidaxomicin Versus Vancomycin for Clostridium difficile Infection: Meta-analysis of Pivotal Randomized Controlled Trials. In: Clinical Infectious Diseases. 55, Suppl. 2, 8. Januar 2012, S. 93–103, doi:10.1093/cid/cis499, PMID 22752871.
- Jennifer S. Hardesty, Paul Juang: Fidaxomicin: A Macrocyclic Antibiotic for the Treatment of Clostridium difficile Infection. In: Pharmacotherapy. Band 31, Nr. 9, 2011, S. 877–886, doi:10.1592/phco.31.9.877, PMID 21923589.
- Gemeinsamer Bundesausschuss: Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII - Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Fidaxomicin. In: Arzneimittel-Richtlinie (AM-RL): Anlage XII. 4. Juli 2013 (g-ba.de [PDF; 135 kB]).
Einzelnachweise
- uniscience: fidaxomicin (PDF; 138 kB).
- Datenblatt Fidaxomicin ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 20. November 2021 (PDF).
- Dificlir bei CDI | Tillotts Pharma für die Gesundheit des Verdauungssystems. In: Tillotts DE. Abgerufen am 14. Oktober 2022 (amerikanisches Englisch).
- Beschluss zum Zusatznutzen (Memento des vom 9. Februar 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen: Fidaxomicin bei Clostridium-difficile-Infektion: Zusatznutzen nicht belegt. 15. April 2013 (iqwig.de).