Oleochemie
Die Oleochemie (auch Fettchemie) ist ein Zweig der Chemie, der sich mit dem Studium von pflanzlichen und tierischen Fetten, ihren Folgeprodukten, sowie mit den petrochemisch hergestellten Produktäquivalenten beschäftigt. Da die Oleochemie sich überwiegend mit der Chemie auf Basis nachwachsender Rohstoffe beschäftigt, ist sie auch eng mit dem Begriff der Nachhaltigkeit verknüpft.
.jpg.webp)

Pflanzliche und tierische Fette werden in der Chemie als Triacylglyceride (Triglyceride) bezeichnet, da sie aus einem Glycerinrest bestehen, an den über Esterbindungen drei Fettsäurereste gebunden sind. Die Fettsäurereste bestehen dabei aus gesättigten, einfach oder mehrfach ungesättigten, unverzweigten oder verzweigten oder anders modifizierten Kohlenstoffketten mit etwa 10 bis 20 oder mehr Kohlenstoffatomen, so dass eine große Vielfalt vorhanden ist. Die Oleochemie beschäftigt sich mit diesen Verbindungen und daraus abgeleiteten Substanzen und den entsprechenden chemischen Reaktionen und Herstellungsprozessen.
Geschichte
Öle und Fette sind ein wichtiger und energiereicher Bestandteil der menschlichen Nahrung. Aber auch die stoffliche Verwendung ist historisch bedeutend. Als die erste oleochemische Anwendung der Öle und Fette kann die Herstellung von Seifen angesehen werden. Früh war auch schon die energetische Verwendung zum Beispiel als Brennstoff für Öllampen bekannt.
Im 19. Jahrhundert begann die moderne Oleochemie und es erfolgte eine systematische Untersuchung der Eigenschaften und der chemischen Reaktionen. Heutzutage ist die Oleochemie in vielen Bereichen des Lebens wie der Nahrungsmittelherstellung, der Kosmetik, der Pharmazie sowie für die Herstellung industrieller Grundchemikalien wie auch im Energiesektor bei der Herstellung des Biokraftstoffs Biodiesel vertreten. Ungefähr ein Siebtel der global hergestellten Menge an Ölen und Fetten wird oleochemisch verarbeitet.
Rohstoffbasis
Die natürlich vorkommenden Fette und Öle unterscheiden sich hauptsächlich durch die Kettenlängenverteilung sowie die Zahl der Doppelbindungen in der Kohlenstoffkette.[1]
| Fettsäure | Kettenlänge | Hauptquelle | Hauptanwendung |
|---|---|---|---|
| Caprylsäure | 8 | Cuphea | Reinigungsmittel |
| Caprinsäure | 10 | Cuphea | Reinigungsmittel |
| Laurinsäure | 12 | Kokospalme | Reinigungsmittel |
| Myristinsäure | 14 | Muskat | Seife |
| Palmitinsäure | 16 | Ölpalme | Margarine, Biodiesel |
| Petroselinsäure | 18 | Koriander | Reinigungsmittel |
| Ölsäure | 18 | Raps | Speiseöl, Biodiesel |
| α-Linolensäure | 18 | Lein, Leindotter | Linoleum |
| Calendulasäure | 18 | Ringelblume | Parfüm, Schmiermittel |
| Ricinolsäure | 18 | Ricinus | Schmiermittel |
| Vernolsäure | 18 | Vernonia, Euphorbia | Epoxyharze |
| α-Eleostearinsäure | 18 | Aleurites | Lack |
| Eicosensäure | 20 | Limnanthes | Schmiermittel |
| Erucasäure | 22 | Raps, Krambe | Schmiermittel |
| Nervonsäure | 24 | Lunaria | Schmiermittel |
Sojaöl war im Jahr 2016 mit einem Anteil von 61 % weltweit vor Palm- und Rapsöl das am meisten produzierte Pflanzenöl. Der Gesamtverbrauch im Jahr 2016 betrug 340,8 Millionen Tonnen.[3]
Die folgende Tabelle zeigt die Anteile der verschiedenen Fettsäurereste in Triglyceriden technisch bedeutender Öle in Prozent, in Klammern jeweils die Anzahl der Kohlenstoff-Atome sowie der Doppelbindungen im Molekül.
| Substanz |
Herkunft |
Capryls. (8), Caprins. (10), Laurins. (12) |
Myristin- säure (14) |
Palmitin- säure (16) |
Stearin- säure (18) |
Arachin- säure (20) |
Behen- säure (22) |
Öl- säure (18:1) n-9 |
Linol- säure (18:2) n-6 |
Linolen- säure (18:3α) n-3 |
Gamma- Linolen säure (18:3γ) n-6 |
(20:1,2) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Palmkernöl | Palmfrucht (Kerne) | 57 | 16 | 8 | 2,5 | 14 | 2,5 | |||||
| Palmöl | Palmfrucht (Fruchtfleisch) | 1 | 43,8 | 5 | 0,5 | 39 | 10 | |||||
| Rapsöl | Raps (Samen) | 4 | 1,5 | 0,5 | 63 | 20 | 9 | 1 | ||||
| Sojaöl | Sojabohne | 10 | 4 | 23 | 51 | 7 (oder <1) |
Anwendungen

Nachwachsende Rohstoffe decken momentan ungefähr zehn Prozent des Rohstoffsbedarfs der chemischen Industrie, davon ein großer Teil durch Oleochemikalien. Eine der mengenmäßig größten Anwendungen ist heutzutage die Herstellung von Biodiesel durch Umesterung mit Methanol.
Auch die Herstellung von Tensiden aus der Fettsäure Laurinsäure zu Natriumlaurylsulfat (Anionische Tenside), einem wichtigen Inhaltsstoff in vielen Hautpflegeprodukten, ist ein großtechnischer Prozess. Bei Zuckertensiden (nichtionische Tenside) wird die Fettsäure an einen Zucker gebunden.
Andere Anwendungen sind die Herstellung von Schmierölen, Lösungsmitteln und Bio- und Copolymeren für den Kunststoff- und Lackbereich. Glycerin wird in vielfältiger Weise im Kosmetikbereich genutzt. Da es durch die Biodieselproduktion in großen Mengen verfügbar ist, wird es aber auch als Tierfutter, energetisch und anderweitig verwendet.[4]
Chemische Prozesse
Oleochemie findet meist an der Carboxygruppe (-COOH) als funktionelle Gruppe der Fettsäuren statt. Bislang ist die Chemie der Fettsäurekette mit Ausnahme des Rizinusöls, deren Fettsäurekette von Natur aus eine Hydroxygruppe aufweist, nur wenig genutzt. Deren Erforschung könnte ein großes technisches Potential darstellen und wird durch Programme des Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz (BMELV) unterstützt.[5]
Die biogene Herkunft der Öle prädestiniert diese für die biotechnologische Umsetzung, die bislang ebenfalls nur wenig erforscht ist.
Hydrolyse
Durch Hydrolyse von Triglyceriden erhält man Fettsäuren und Glycerin:
Die Reaktion kann sowohl säure- als auch basenkatalysiert durchgeführt werden. Die Folgechemie der Fettsäuren ist vielfältig. Sie umfasst die Herstellung von Nitrilen und deren Folgeprodukte, Fettsäureamiden oder Säurechloriden.
Umesterung
Die Reaktion der Fette und Öle mit einem Alkohol nennt man Umesterung. Der Prozess wird großtechnisch zur Produktion von Biodiesel eingesetzt. Auch diese Reaktion wird in der Technik basenkatalysiert durchgeführt. Als Produkt entstehen bei vollständiger Umsetzung aus einem Triacylglycerid drei Fettsäuremethylester (FAME), aus denen Biodiesel besteht, sowie als Koppelprodukt ein Molekül Glycerin.

Die entstehenden Methylester der ungesättigten Fettsäuren können eine breite Palette von Folgereaktionen, wie der Hydrierung, der Metathese sowie der Epoxidierung, eingehen.[6][7]
Verseifung
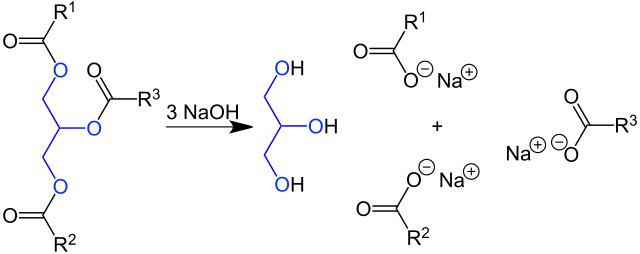
Die Verseifung ist einer der ältesten bekannten chemischen Prozesse der Menschheit und wurde schon von den Sumerern verwendet. Dabei wird das Triglycerid (= Triester des Glycerins) mit einer Base – hier Natronlauge – zum Metallsalz (hier Natriumsalz) der Fettsäure umgesetzt. Diese so erhaltene Seife (= Natriumsalze von Fettsäuren) zählt zu den anionischen Tensiden. R1, R2 und R3 Organylreste (Alkyl- oder Alkenylreste) von Fettsäuren:
Hydrierung
Durch Hydrierung der Methylester gelangt man zu Fettalkoholen, die eine wichtige Rolle als Rohstoff für die Herstellung anionischer Tenside darstellen. Durch Ethoxylierung und anschließender Sulfatierung mit gasförmigem Schwefeltrioxid gelangt man zu Laurylethersulfaten, die in der Herstellung von Körperpflegemitteln eingesetzt werden.
Eine weitere Anwendung der Fettalkohole ist die Herstellung der Alkylpolyglycoside, einem Tensid mit einem Zuckerrest (ein Zuckertensid) als hydrophile Gruppe.[8]
Metathese
Durch Metathese von ungesättigten Fettsäureestern gelangt man zu einer breiten Palette von Folgeprodukten, wie beispielsweise ungesättigten Dicarbonsäureestern und internen Olefinen.[9] Durch Ethenolyse sind ω-ungesättigte Fettsäureester zugänglich, mit α-Olefinen als Beiprodukt. Diese beiden Produkte können wiederum als Komponente in die Copolymerisations-Komponente bei der Polymerisation von Ethylen nach dem Ziegler-Natta-Verfahren eingesetzt werden und so zu funktionalisierten Polyethylen führen.
Epoxidierung
Ungesättigte Methylester lassen sich durch die Prileschajew-Reaktion mit einer organischen Peroxycarbonsäure epoxidieren und können als PVC-Stabilisatoren oder als reaktives Lösungsmittel in der Lack-Chemie eingesetzt werden.
Petrochemische Prozesse
Die Oleochemie befasst sich auch mit der Herstellung von Oleochemikalien auf petrochemischer Basis. Ein Beispiel hierfür ist die Herstellung von Glycerin aus Propylen über die Stufen des Allylchlorids, Dichlorhydrin und Epichlorhydrin, welches mit Natronlauge zu Glycerin umgesetzt werden kann.
Siehe auch
Literatur
- Siegfried Warwel, Nikolaus Weber: Lipide als funktionelle Lebensmittel. Landwirtschaftsverlag, Münster 2002, ISBN 3-7843-0495-8.
Weblinks
Einzelnachweise
- Fettsäurezusammensetzung wichtiger pflanzlicher und tierischer Speisefette und -öle (Memento des vom 22. Dezember 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- Herausforderungen für die Züchtung von Pflanzen als Nachwachsende Rohstoffe.
- International: World Oilseed Production. In: soystats.com. American Soybean Association, abgerufen am 6. November 2017 (englisch).
- Deutsche Melasse Handelsgesellschaft mbH (DMH): Was ist Glycerin? (Memento des vom 2. Februar 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Informationsseite, abgerufen am 11. Februar 2010.
- Förderprogramm Nachwachsende Rohstoffe (Memento des vom 18. August 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (Programm des Bundesministeriums für Ernährung, Landwirtschaft und Verbraucherschutz).
- Siegfried Warwel: Metathese in der Oleochemie (PDF; 161 kB).
- Mark Rüsch gen. Klaas: Epoxidierte Fettsäuren und Triglyceride. (Memento vom 16. Januar 2014 im Internet Archive) In: Die aktuelle Wochenschau der GDCh. 2008 (Version aus dem Internet-Archiv vom 16. Januar 2014).
- Karlheinz Hill, Manfred Weuthen: Alkylglucoside – Tenside aus Zucker und Pflanzenöl. In: Spektrum der Wissenschaft. Nr. 6, 1994.
- P. B. van Dam, M. C. Mittelmeijer, C. Boelhouwer: Metathesis of unsaturated fatty acid esters by a homogeneous tungsten hexachloride–tetramethyltin catalyst. In: Journal of the Chemical Society, Chemical Communications. Nr. 22, 1972, S. 1221–1222. doi:10.1039/C39720001221.