Europium(III)-nitrat
Europium(III)-nitrat (Eu[NO3]3) ist ein anorganisches Salz aus Europium und der Salpetersäure. Das Hexahydrat (Eu[NO3]3∙6H2O) ist die verbreitetste Form, welche farblose hygroskopische Kristalle bildet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
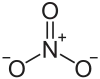 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Europium(III)-nitrat | |||||||||||||||
| Andere Namen |
Europiumtrinitrat | |||||||||||||||
| Summenformel | Eu(NO3)3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,35 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser (Hexahydrat)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||

Gewinnung und Darstellung
Europiumsesquioxid (Eu2O3) wird in Salpetersäure gelöst und dann zur Trockene eingeengt.[5]
Eigenschaften
Das wasserfreie Europium(III)-nitrat kristallisiert im Tb[NO3]3-Typ, monoklin in der Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterparametern a = 1109,4(1), b = 618,50(8), c = 975,2(1) pm, β = 93,034(9)° mit vier Formeleinheiten pro Elementarzelle.[3] Europium(III)-nitrat beginnt bei 317 °C sich zu zersetzen, die in drei Schritten zum Europiumsesquioxid abläuft.[4]
Erster Schritt (301–362 °C):
Zweiter Schritt (428–461 °C):
Dritter Schritt (575–600 °C):
Das Hexahydrat wandelt sich bei etwa 65 °C (ähnlich wie andere Nitrathexahydrate) in eine klare Flüssigkeit um. Diese Flüssigkeit beginnt bei etwa 112 °C zu sieden und sofort nach gasförmiger Salpetersäure zu riechen.[6]
Verwendung
Europium(III)-nitrat kann mit 1,3,5-Tricarboxybenzol (Trimesinsäure, TMA) reagieren und bildet eine Europium Metallorganische Gerüstverbindung (Eu-MOF).[7][8] Europium(III)-nitrat kann auch verwendet werden um EuPO4∙nH2O Nanoröhrchen zu erhalten.[9] Es wird auch bei der Synthese von lichtemittierenden Nanomaterialien verwendet.[10]
Einzelnachweise
- Datenblatt Europium(III) nitrate pentahydrate, 99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 6. Juni 2020 (PDF).
- Robert A. Lewis: Hawley's Condensed Chemical Dictionary. John Wiley & Sons, 2016, ISBN 978-1-119-26784-3, S. 601 (eingeschränkte Vorschau in der Google-Buchsuche).
- Christina Heinrichs: Synthese und Charakterisierung wasserfreier seltenerdmetall-Nitrate, Acetate und –Oxyacetate. 1. Auflage. Verlag Dr. Hut, München 2013, S. 1–243.
- B. N. Ivanov-Emin, Yu N. Medvedev: The thermal decomposition of anhydrous lanthanide nitrates. In: Russian Journal of Inorganic Chemistry. Band 35, Nr. 2, 1990, S. 168–170.
- Odent, Guy; Charetteur, Elisabeth; Duperray, Marie H.: Crystallization, radiocrystallographic characterization, and infrared absorption spectra of hexahydrates and pentahydrates of nitrates and lanthanides. In: Revue de Chimie Minerale. Band 12, Nr. 1, 1975, S. 17–23.
- P. Melnikov, I. V. Arkhangelsky u. a.: Thermal properties of europium nitrate hexahydrate Eu(NO3)3-6H2O. In: Journal of Thermal Analysis and Calorimetry. 128, 2017, S. 1353, doi:10.1007/s10973-016-6047-9.
- Habimana, Fabien; Huo, Yanxia; Jiang, Sai; Ji, Shengfu: Synthesis of europium metal-organic framework (Eu-MOF) and its performance in adsorptive desulfurization. In: Adsorption. Band 22, Nr. 8, 2016, S. 1147–1155, doi:10.1007/s10450-016-9838-1.
- Tanase, Stefania; Mittelmeijer-Hazeleger, Marjo C.; Rothenberg, Gadi; Mathoniere, Corine; Jubera, Veronique; Smits, Jan M. M.; de Gelder, Rene: A facile building-block synthesis of multifunctional lanthanide MOFs. In: Journal of Materials Chemistry. Band 21, Nr. 39, 2011, S. 15544–15551, doi:10.1039/c1jm12789f.
- Chitta Ranjan Patra, Gabashvili Alexandra, Sujata Patra, David Solomon Jacob,Aharon Gedanken, Asher Landau, Yossi Gofer: Microwave approach for the synthesis of rhabdophane-typelanthanide orthophosphate (Ln = La, Ce, Nd, Sm, Eu, Gdand Tb) nanorods under solvothermal conditions. In: New J. Chem. Band 29, 2005, S. 733–739, doi:10.1039/b415693e.
- Datenblatt Europium(III) nitrate hexahydrate, REacton®, 99.9% (REO) bei Alfa Aesar, abgerufen am 6. Juni 2020 (Seite nicht mehr abrufbar).

