Ergovalin
Ergovalin ist eine natürlich vorkommende chemische Verbindung aus der Gruppe der Mutterkornalkaloide. Es wird als ein Hauptalkaloid von den symbiotisch in und auf verschiedenen Süßgräsern lebenden Pilzen der Gattungen Epichloë und Neotyphodium produziert.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
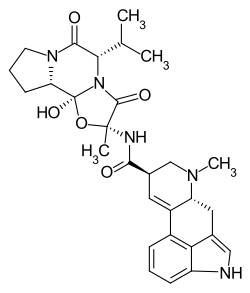 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ergovalin | ||||||||||||
| Andere Namen |
12′-Hydroxy-2′-methyl-5′α-(1-methylethyl)-ergotaman-3′,6′,18-trion | ||||||||||||
| Summenformel | C29H35N5O5 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 533,6 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
207–208 °C (unter Zersetzung)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Ergovalin wurde zuerst im Jahr 1964 von Albert Hofmann und Mitarbeitern als ein reines Syntheseprodukt ohne ein zu diesem Zeitpunkt bekanntes natürliches Korrelat beschrieben.[3] Bei Feldversuchen mit dem Purpurbraunen Mutterkornpilz (Claviceps purpurea) im Jahr 1967 konnte Ergovalin als ein natürlich vorkommendes Alkaloid identifiziert werden.[1] Es dauerte noch über ein Jahrzehnt, bis das Vorkommen dieses Alkaloids in mit Gras-Kernpilz (Epichloë typhina) infizierten Gräsern nachgewiesen und seine Bedeutung als Hauptursache der Schwingelvergiftung (Fescue toxicosis) bei Weidevieh erkannt wurde.[4][5]
Vorkommen
Das Vorkommen von Ergovalin wurde in verschiedenen Süßgräsern nachgewiesen. Für die Produktion des Alkaloids sind jedoch nicht die Gräser, sondern die mit ihnen in einer symbiotischen Gemeinschaft lebenden Pilze der Gattungen Epichloë und Neotyphodium verantwortlich.[6] Mit einem Anteil von 4 Prozent in der Alkaloidfraktion kann Ergovalin darüber hinaus als ein Nebenalkaloid des Purpurbraunen Mutterkornpilzes angesehen werden.[1]
Eigenschaften
Chemische und physikalische Eigenschaften
Ergovalin gibt die typischen Nachweisreaktionen auf Mutterkornalkaloide einschließlich der Van-Urk-Reaktion. In seinen physikochemischen Eigenschaften ähnelt es anderen Mutterkornalkaloiden, insbesondere Ergosin.[1]
Stereochemie
Ergovalin ist ein chiraler Naturstoff mit sechs Asymmetriezentren. In wässriger Lösung neigt Ergovalin zur C8-Epimerisierung zum Ergovalinin.
Biologische Bedeutung
Das Vorkommen von Ergovalin in Weidegräsern, die mit endophytischen Pilzen der Gattungen Epichloë und Neotyphodium besiedelt sind, wird als die Hauptursache für die Schwingelvergiftung bei Weidevieh angesehen. In seinen Symptomen ähnelt die Schwingelvergiftung dem Ergotismus bei Tieren. Zu den Symptomen zählen insbesondere erhöhte Körpertemperatur, verringerte Gewichtszunahme, Gangrän, erniedrigte Prolaktinspiegel und verringerte Reproduktivität.[7]
In seiner Pharmakologie ähnelt Ergovalin dem Mutterkornalkaloid Ergotamin. Auf molekularer Ebene aktiviert Ergovalin unter anderem die Serotoninrezeptoren 5-HT1B und 5-HT2A, den Dopaminrezeptor D2 sowie α1-Adrenozeptoren.[8][9][10]
Einzelnachweise
- Rudolf Brunner, Peter Leopold Stütz, Hans Tscherter, Paul Albert Stadler: Isolation of ergovaline, ergoptine, and ergonine, new alkaloids of the peptide type, from ergot sclerotia. In: Canadian Journal of Chemistry. 57 (13), 1979, S. 1638–1641, doi:10.1139/v79-263.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P. A. Stadler, A. J. Frey, H. Ott, A. Hofmann: Die Synthese des Ergosins und des Valin-Analogen der Ergotamin-Gruppe. 61. Mitteilung über Mutterkornalkaloide. In: Helvetica Chimica Acta. 47. Jahrgang, Nr. 7, 1964, S. 1911–1921, doi:10.1002/hlca.19640470731.
- Shelly G. Yates and Richard G. Powell: Analysis of ergopeptine alkaloids in endophyte-infected tall fescue. In: Journal of Agricultural and Food Chemistry. 36. Jahrgang, Nr. 2, 1988, S. 337–340, doi:10.1021/jf00080a023.
- James K. Porter, Charles W. Bacon, Joe D. Robbins, Don Betowski: Ergot alkaloid identification in clavicipitaceae systemic fungi of pasture grasses. In: J. Agric. Food Chem. 29. Jahrgang, Nr. 3, 1981, S. 653–657, doi:10.1021/jf00105a055.
- J. F. White Jr., G. Morgan-Jones, A. C. Morrow, A.C.: Taxonomy, life cycle, reproduction, and detection of Acremonium endophytes. In: Agric. Ecosystems and Environ. 44. Jahrgang, Nr. 13–37, 1993.
- J. R. Strickland, J. W. Oliver, D. L. Cross: Fescue toxicosis and its impact on animal agriculture. In: Vet Hum Toxicol. 35. Jahrgang, Nr. 5, 1993, S. 454–464, PMID 8249272.
- B. T. Larson, D. L. Harmon, E. L. Piper, L. M. Griffis, L. P. Bush: Alkaloid binding and activation of D2 dopamine receptors in cell culture. In: J. Anim. Sci. 77. Jahrgang, Nr. 4, 1999, S. 942–947, PMID 10328360.
- D. C. Dyer: Evidence that ergovaline acts on serotonin receptors. In: Life Sci. 53. Jahrgang, Nr. 14, 1993, S. PL223–PL228, PMID 8371626.
- C. Schöning, M. Flieger, H. H. Pertz: Complex interaction of ergovaline with 5-HT2A, 5-HT1B/1D, and alpha1 receptors in isolated arteries of rat and guinea pig. In: J. Anim. Sci. 79. Jahrgang, Nr. 8, 2001, S. 2202–2209, PMID 11518230.