Gehörnter Schwammkäfer
Ennearthron cornutum ist ein Käfer aus der Familie der Schwammkäfer. Die Gattung Ennearthron ist in Europa mit 6 Arten vertreten.[1] Gelegentlich wird der deutsche Name Gehörnter Schwammkäfer benutzt.[2]
| Gehörnter Schwammkäfer | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
_(31439777384).png.webp)
Ennearthron cornutum, Weibchen | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Ennearthron cornutum | ||||||||||
| (Gyllenhaal, 1827) |
Bemerkungen zum Namen und Synonymen
Der Käfer wurde erstmals 1827 von Gyllenhaal unter dem Namen Cis cornutus beschrieben. Die lateinische Kurzbeschreibung enthält den Teilsatz thorace capiteque maris antice bicornutus (lat. dabei Brust und Kopf des Männchens vorn zweigehörnt).[3] Dies erklärt den Artnamen cornutum von lat. gehörnt.[4]
Der Gattungsname Ennearthron ist von altgr. εννέα "ennéa" für "neun" und άρθρον "árthron" für "Glied" abgeleitet.[5] Der Name bezieht sich auf die Fühler, denn die Gattung Ennearthron wurde wegen der neungliedrigen Fühler 1847 durch Mellié von der Gattung Cis abgetrennt, in der die Käfer mit zehngliedrigen Fühlern verblieben.[6]
Nach der Umbenennung von Cis cornutus in Ennearthron cornutum wurde der Name Cis cornutus von Blatchley 1910 für einen nordamerikanischen Käfer neu vergeben.[7]
Gelegentlich wird Ptinus concinnus als Synonym für Ennearthron cornutum angegeben.[8][9] Die Beschreibung von Ptinus concinnus durch Marsham 1802[10] allein ist aber zu dürftig, um nachvollziehen zu können, dass es sich um die gleiche Käferart handelt.
| Bilder des Männchens | |
   | |
| Abb. 1: Männchen von oben, unten und vorn | |
 |
 |
| Abb. 2: Seitenansicht des Vorderteils, Kopie links koloriert, grün Halsschild, blau Kopfschild |
Abb. 3: Fühler, nach Fowler[11] |
Merkmale des Käfers
Der Käfer erreicht eine Länge von eineinhalb bis knapp zwei Millimetern und ist etwa 0,4 mal so breit wie lang. Der stark gewölbte Körper ist zylindrisch bräunlich bis rötlich braun und leicht glänzend. Die Unterseite ist dunkler, Beine, Taster und Fühler sind gelb, die Fühlerspitze dunkler. Die kurze Behaarung ist grau bis gelblich, schuppenartig und abstehend.
Der Kopf ist breiter als lang. Er ist kräftig, aber nicht dicht punktiert. Er hat auf der Stirn ein Grübchen und ist vorn quer eingedrückt. Davor ist beim Weibchen der Kopfschild leicht aufgebogen und fast gerade abgeschnitten, beim Männchen ist der aufgebogene Kopfschild in der Mitte ausgeschnitten, daneben auf beiden Seiten zu einem dunkler gefärbten Zahn ausgezogen (Abb. 2 links blau). Die schwarzen Augen sind deutlich gewölbt. Die neungliedrigen Fühler (Abb. 3) sind am Innenrand der Augen eingelenkt. Die drei großen, voneinander getrennten Endglieder des Fühlers bilden eine lockere Keule. Das Endglied ist spürbar länger als die beiden vorletzten Glieder. Das Grundglied der Fühler ist groß mit gestieltem Endknopf, das zweite Glied viel kleiner, kurz und eiförmig. Das dritte Glied ist dünn und so lang wie die drei folgenden zusammen. Diese sind etwa gleich groß und breiter als lang. Der Oberkiefer ist dick, dreiseitig mit gezähnter Spitze. Der Unterkiefer ist zweilappig. Die Kiefertaster sind viergliedrig. Die dreigliedrigen Lippentaster enden mit einem walzenförmigen Glied.
Der Halsschild verengt sich nach vorne. Er ist etwa gleich lang wie breit, beim Männchen etwas breiter. Die Seiten und die Basis des Halsschilds sind fein gerandet, die Vorderwinkel stumpf, die Hinterwinkel abgerundet. Der Seitenrand ist beim Weibchen von oben größtenteils sichtbar, beim Männchen wegen des stärker größeren Halsschilds nur nahe den Hinterwinkeln. Vorn überragt der Halsschild den Kopf. Beim Weibchen ist er dort einfach gerundet, beim Männchen tief ausgeschnitten und seitlich je in ein Hörnchen ausgezogen (Abb. 2 links grün). Die Hörnchen des Halsschilds verlaufen grob parallel zu den Zähnchen des Kopfschildes, der Ausschnitt am Halsschild ist jedoch tiefer als der Ausschnitt am Kopfschild, die Hörnchen entsprechend am Halsschild spitzer und die Zähnchen am Kopfschild breiter und weniger weit auseinander gestellt als die Hörnchen am Halsschild. Die Punktierung ist mäßig kräftig und sehr dicht, die Zwischenräume sind glatt, beim Weibchen kleiner als die Punkte selbst. Die Schuppenhaare stehen in verschiedenen Richtungen ab, überwiegend sind sie nach hinten ausgerichtet.
Das Schildchen ist klein, rundlich bis dreieckig.
Die Flügeldecken sind mehr als doppelt so lang wie der Halsschild und knapp ein dreiviertel mal so lang wie zusammen breit. Nach hinten verbreitern sie sich beim Weibchen etwas, beim Männchen kaum. Die Punktierung ist etwas dichter als auf dem Halsschild. Die Zwischenräume zwischen den Punkten sind leicht runzelig und in beiden Geschlechtern kleiner als die Punkte selbst. Die Schuppenhaare sind undeutlich gereiht. Die Flügeldecken sind zum Ende hin zugespitzt verrundet.
Die Beine sind gelb. Die Tarsen sind viergliedrig, das erste Glied ist im Ausschnitt der Schiene versteckt, das Endglied länger als die vorhergehenden zusammen. Der äußerste Spitzenwinkel der Vorderschienen ist beim Männchen in einen Zahn ausgezogen, beim Weibchen ist dieser schwächer und häufig kaum ausgebildet (Taxobild).[12][13][11][14][15][16][17]
Larve
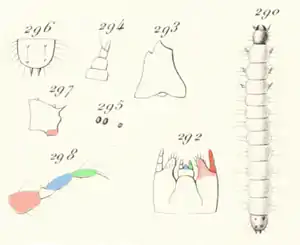
Die langgestreckte Larve (Abb. 5, Fig. 290) wird im letzten Stadium etwa drei Millimeter lang. Sie besteht aus dem Kopf, dem dreigliedrigen Brustabschnitt und neun Hinterleibssegmenten. Die Abmessungen der Brustsegmente unterscheiden sich nicht wesentlich von denen des Hinterleibs. Bis auf die leicht abgeplattete Unterseite der Brustsegmente, Kopf und Analsegment ist die Larve zylindrisch. Außer Kopf und Körperende ist sie weiß oder sehr blass rötlich und von fleischiger Konsistenz.
Der rundliche Kopf ist glatt, er trägt auf dem Scheitel eine kurze Längsfurche und auf der Stirn ist ein quer liegendes Grübchen angedeutet. Der Kopf trägt feine Haare unterschiedlicher Länge. Er ist rötlich, am Vorderrand dunkler. Die rötliche Oberlippe hat die Form einer Halbscheibe und ist sehr fein behaart. Die kräftigen und gehärteten Oberkiefer (Abb. 5, Fig. 293) sind im vorderen Drittel schwarz und berühren sich kaum. Von unten betrachtet erscheinen sie abgeschrägt und von der Seite gesehen erkennt man gegenüber der Abschrägung einen Zahn. Der Lobus der Unterkiefer (Abb. 5, Fig. 292 hellrot) ist länglich, an der Spitze abgerundet und mit borstenartigen Cilien gerandet, die eine Art Rechen bilden. Die Maxillarpalpen (Abb. 5, Fig. 292 dunkelrot) überragen kaum den Lobus. Sie sind leicht nach innen gekrümmt und dreigliedrig, die Glieder etwa gleich lang und sich nach vorn verjüngend. Die Unterlippe (Abb. 5, Fig. 292 blau) ist zwischen den beiden kurzen, zweigliedrigen Lippentastern (Abb. 5, Fig. 292 grün) verschmälert und verlängert. Die Fühler sind in Abb. 5, Fig. 294 abgebildet. Das vorletzte Glied ist an der Spitze schräg abgeschnitten und wird an der Innenseite durch einen kleinen Auswuchs überragt, der in einem langen Haar endet. Das letzte Glied ist sehr schlank und etwas nach außen gerückt eingelenkt. Auf jeder Seite des Kopfes befinden sich nicht ganz in einer Reihe liegend drei schwarze Ozellen, von denen zwei einander genähert sind (Abb. 5, Fig. 295).
Der Brustabschnitt ist etwas breiter als der Kopf und trägt an den Seiten und oben einige steife Haare. Das erste Glied ist länger und etwas schmaler als die beiden folgenden, vorn ist es leicht abgerundet. Jedes der drei Segmente des Brustabschnittes trägt ein Paar kurzer, seitlich abstehender Beine (Abb. 5, Fig. 298). Die kräftigen Hüften (Fig. 298 rot) sind konisch. Schenkel (Fig. 298 blau) und Schienen (Fig. 298 grün) sind lang behaart und etwa gleich lang. Die rötlichen Krallen sind leicht gekrümmt.
Der Hinterleib ist oben, unten und seitlich zerstreut behaart. Die beiden ersten Segmente sind etwas kleiner als die folgenden. Das siebte Hinterleibssegment ist oberseits sehr schwach rötlich, das achte ist außer am Vorder- und Hinterrand rötlich, das letzte Segment (Analsegment) ist rot, überall dichter behaart und stärker chitinisiert. Dieses Segment (Abb. 5, Fig. 296 von oben und Fig. 297 von der Seite) endet in zwei parallelen, einander genäherten, kurzen, leicht aufgebogenen, spitzen und harten Körperanhängen. Auf der Unterseite dieses Segments befindet sich eine einziehbare Analwarze (in Fig. 296 rötlich koloriert). Die Oberseite des Analsegments ist abgeplattet und trägt eine löffelartige Vertiefung. In dieser entspringen vier dreieckige, spitz zulaufende Zähnchen, die weit voneinander entfernt sind; die vorderen sind deutlich kleiner als die hinteren.
Das erste Stigmenpaar befindet sich am Vorderrand des mittleren Brustabschnittes, die weiteren liegen im ersten Drittel der ersten acht Hinterleibssegmente.[13][19][18]
Puppe
Die Puppe ähnelt bereits deutlich der Imago, man kann beim Männchen schon die Fortsätze des Halsschildes erkennen. Die Puppe ist weichhäutig und nur spärlich behaart. Seitlich der Vorderbrust findet man einige sehr feine weiße Haare, auf dem Rücken der Vorder-, Mittel- und Hinterbrust erkennt man zwei Reihen von jeweils sechs oder acht ebensolchen Haaren. Auf dem Rücken des Hinterleibs befinden sich acht Längsreihen solcher Haare. Der Hinterleib endet in zwei etwas zurückgebogenen Warzen mit leicht verhornter Spitze. Sie ermöglichen es, dass die Puppe sich abstützen und dadurch Krümmungen des Hinterleibs seine Lage verändern kann.[13]
Biologie
Der Käfer ernährt sich als Larve und als Imago von Pilzen. Man findet den Käfer an dürren und verpilzten Zweigen von Bäumen, die von Baumschwämmen mit harten Fruchtkörpern befallen sind, jedoch hauptsächlich an und in den Fruchtkörpern dieser Pilze, in denen sich auch die Larven entwickeln. Entsprechend dem Vorkommen dieser Pilze werden die Käfer in Laub- und Misch-, seltener in Nadelholzwäldern, aber auch in Parks an Hecken und Einzelbäumen gefunden. An Wirtspilzen werden für Mitteleuropa häufig Arten der Gattung Phellinus (Feuerschwämme) sowie Zottiger Schillerporling, Angebrannter Rauchporling, Eichen-Wirrling, Birkenporling, Rotrandiger Baumschwamm und Zunderschwamm angeführt. Aus der Umgebung von Moskau wird die Anwesenheit des Käfers an zwanzig Schwammarten angegeben.[20] Reibnitz gibt die Anzahl der Wirte mit dreißig an.[21] Das Spektrum der besiedelten Wirtspilze wird bei Ennearthron cornutum nicht wie bei vielen oligophagen Mycetophagen durch den Verwandtschaftsgrad der Wirtspilze, sondern durch die Härte des Fruchtkörpers der Wirte bestimmt. Ennearthron cornutum besiedelt Arten mit harten Fruchtkörpern.[20] Die ausgeprägte Polyphagie des Käfers stellt innerhalb der Schwammkäfer eine Ausnahme dar. Entsprechend den Wirtsbäumen der Wirtspilze werden die Käfer von verschiedenen Laub- und Nadelbäumen gemeldet (Buchen, Eichen, Eschen, Weiden, Birken, seltener Tannen und Kiefern). In Südwestdeutschland stellt der Käfer knapp ein Zehntel aller Funde der dort vorkommenden etwa vierzig Schwammkäferarten. Der Käfer ist dort von der Ebene bis in die hohen Lagen des Schwarzwalds zu finden.[22] In Finnland wurde nachgewiesen, dass bei zunehmender Verkleinerung und Isolierung seines Lebensraums der Käfer seltener wird.[23]
Versuche mit Duftfallen in Finnland zeigen, dass es unter den Wirten des Käfers sowohl solche Arten gibt, deren Duftstoffe den Käfer deutlich anlocken (Rotrandiger Baumschwamm), aber auch andere Wirtsarten (Zunderschwamm), deren Duftstoffe keine statistisch gesicherte Lockwirkung auf den Käfer ausüben.[24] Bei einer Untersuchung in Nordeuropa wurde gezeigt, dass die Käfer zur Fortpflanzung keine Fruchtkörper wählen, die sich in Bodennähe befinden. Vermutlich liegt dies an der erhöhten Feuchtigkeit nahe am Boden.[25] So werden – zumindest im Norden des Verbreitungsgebietes – auch wärmere Standorte mit trockenem Boden und in Südwestlage für die Eiablage bevorzugt.[26]
Die Eiablage auf den Wirten erfolgt erst, wenn diese schon gealtert sind. Dies bestätigt indirekt die Regel, dass monophage Insekten, die sich in Baumschwämmen entwickeln, die Wirtspflanze schon zu einem frühen Entwicklungsstadium der Fruchtkörper besiedeln.[27] Oft ist in alten Fruchtkörpern als einzige Art noch Ennearthron cornutum anzutreffen.[21] Larven des Käfers findet man nur in Pilzen in fortgeschrittenem Zersetzungsstadium, in dem die vegetative Fortpflanzung durch Sporen bereits abgeschlossen ist und der Fruchtkörper weitgehend abgestorben ist, die äußeren und inneren Strukturen jedoch noch gut erkennbar sind. Es wird vermutet, dass nach der Reifung der Sporen die möglicherweise toxischen Abwehrstoffe der Wirtspilze ihre Wirksamkeit verlieren und der Käfer damit keine Resistenz gegen diese entwickeln muss.[28] Es wird jedoch auch die Möglichkeit diskutiert, dass polyphage Mycetophagen relativ leicht eine Multiresistenz gegen die chemischen Abwehrstoffe der Pilze entwickeln, was ihnen die Entwicklung in einem breiten Spektrum von Wirtspilzen ermöglicht.[29] Der bevorzugte Aufenthaltsort der Larven im Fruchtkörper variiert entsprechend dem Wirtspilz (nur in der Trama oder zwischen Hymenophor und Trama) und die Wahl des Pilzteiles scheint sich nach dessen Härte zu richten.[30]
Bei Untersuchungen im Nationalpark Kampinos in Polen wurde der Käfer ganzjährig gefangen. Dabei lagen 43 % aller Fänge im April und Mai, ein zweites, viel flacheres Maximum lag zwischen September und November mit etwa 33 % der Fänge. Fänge unter 1 % gab es lediglich im Dezember.[31] Für Südwestdeutschland ist belegt, dass vom Frühjahr bis zum Herbst nicht nur Käfer, sondern auch frisch geschlüpfte Käfer gefunden werden. Es überwintern sowohl Larven verschiedener Stadien als auch Käfer.[22] Der Entwicklungszyklus von Ennearthron cornutum ist demnach nicht streng an den Jahresverlauf gekoppelt. Über die Entwicklung ist generell bekannt, dass sie bei polyphagen Mycetophagen gewöhnlich länger dauert als bei oligo- oder monophagen.
Verbreitung
Das Vorkommen der Käfers ist auf Eurasien beschränkt. Das Verbreitungsgebiet liegt hauptsächlich in Europa, wo die Art außer in Randlagen überall verbreitet ist. Der Käfer fehlt aber im Süden Europas in Portugal und auf allen Inseln außer Korsika, auch fehlt er in großen Teilen Südosteuropas (Griechenland, europäische Türkei, Slowenien, Mazedonien, Serbien, Montenegro, Albanien, Republik Moldau und Bulgarien). Im Osten wird die Art aus dem Kaukasus, dem Nahen Osten und Belarus gemeldet, sie fehlt aber im süd-, nordwest- und osteuropäischen Russland. Im Norden ist das Vorkommen in den baltischen Staaten unklar, nach einer Quelle kommt der Käfer höchstens in Estland vor, wo das Vorkommen fraglich ist,[1] nach anderer Quelle kommt er sowohl in Estland als auch in Lettland vor.[9] Weiterhin fehlt die Art in der Region von Kaliningrad, auf Island und den nördlicheren Inselgruppen, außerdem gibt es keine Fundmeldungen aus den Kleinstaaten Andorra, Gibraltar, Vatikanstadt, San Marino und Monaco.[1]
Literatur
- Heinz Freude, Karl Wilhelm Harde, Gustav Adolf Lohse (Hrsg.): Die Käfer Mitteleuropas. Band 7: Clavicornia. Spektrum Akademischer Verlag, München 1967, ISBN 3-8274-0681-1, S. 294.
- Klaus Koch: Die Käfer Mitteleuropas. Hrsg.: Heinz Freude. Band 3: Ökologie. Goecke & Evers, Krefeld 1992, ISBN 3-87263-042-3, S. 261.
- Edmund Reitter: Fauna Germanica, die Käfer des Deutschen Reiches V. Band, K.G.Lutz’ Verlag, Stuttgart 1916, S. 104.
- Gustav Jäger (Hrsg.): C. G. Calwer’s Käferbuch. K. Thienemanns, Stuttgart 1876, 3. Auflage, S. 399.
Weblinks
Einzelnachweise
- Fauna Europaea Systematik und Verbreitung von Ennearthron cornutum, abgerufen am 19. Oktober 2017.
- Theodor C. H. Cole: Wörterbuch der Wirbellosen = Dictionary of invertebrates. Springer Spektrum, Berlin / Heidelberg 2017, ISBN 978-3-662-52868-6, S. 370 (Latein, deutsch, englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- Leonhard Gyllenhaal: Insecta Svecica - Classis I Coleoptera. Band I, Teil IV: Lipsiae. Leipzig 1827 Beschreibung Cis cornutus in der Google-Buchsuche.
- Sigmund Schenkling: Erklärung der wissenschaftlichen Käfernamen (Art)
- Sigmund Schenkling: Erklärung der wissenschaftlichen Käfernamen (Gattung).
- Unter Mélanges et Nouvelles (Vermischtes und Neuigkeiten) von Guérin-Méneville vorgetragener Entwurf von Mellié zur Monographie der Gattung Cis in Revue Zoologique par la Société Cuvierienne. Band 10, Paris 1847 S. 110 Ennearthron
- W. S. Blatchley: An illustrated descriptive catalogue of the Coleoptera or beetles (exclusive of the Rhynchophora) known to occur in Indiana with bibliography and descriptions of new species. Indianapolis 1912 S. 898 Cis cornutus n. sp.
- Synonym bei BioLib (tschechisch).
- Olivier Rose: Les Ciidae de la faune de France continentale et de Corse mise à jour de la clé des genres et du catalogue des espèces (Coleoptera, Tenebrionoidea). In: Bulletin de la Société Entomologique de France. 117, Nr. 3, 2012, S. 339–362, hier S. 352 (researchgate.net PDF).
- Thomas Marsham: Entomologia britannica sistens insecta Bretanniae indigena …. Band 1: Coleoptera. S. 87, Nr. 19
- Canon Fowler: The Coleoptera of the British Islands. Band 4, London 1890 Beschreibung von Ennearthron cornutum, Tafel 119, Fig. 11a Fühler von Ennearthron cornutum.
- Ciidae Bestimmungstabelle im Coleonet.
- Èdouard Perris: Histoire des Insectes du Pin maritime (Suite 1) In: Annales de la Société Éntomologique de France 3. Serie, 12. Band, Paris 1854 Beschreibung der Larve von Ennarthron cornutum S. 639, Abb. zur Larve Tafel 18 in den Annalen (Tafel 6 nach Perris) Fig. Nr. 290–298, Beschriftung der Figuren
- H.C. Küster, Kraatz, Schilsky: Die Käfer Europas - nach der Natur beschrieben. 37. Heft, Nürnberg 1900, S. 129 (biodiversitylibrary.org).
- W. F. Erichson et al.: Naturgeschichte der Insecten Deutschlands 5. Band, Teil 1, Berlin 1877 S. 189 Ennearthron cornutum.
- Ludwig Redtenbacher: Fauna Austriaca – Die Käfer 3. Auflage, 2. Band, Wien 1874 S. 72
- Elzéar Abeille de Perrin: Essai monographique sur les Cesides européens & circaméditerranéens. Marseille 1874 S. 83 in der Google-Buchsuche.
- Uunio Saalas: Die Fichtenkäfer Finnlands 2. Band, Helsinki 1923 Bestimmungsschlüssel der Larve, Tafel 1 Fig. 23 Analglied von der Seite.
- Protokoll zum Beitrag von Mellié in der Sitzung der Entomologischen Gesellschaft vom 25. April 1849 über die Larven von Ropalodontus perforatus und Ennearthron cornutum in Annales de la Société Éntomologique de France. 2. Serie, 7. Band, Paris 1849 S. XL
- Nikolay B. Nikitsky, Dmitry S. Schigel: Beetles in polypores of the Moskow region. In: Entomologica Fennica. 29. April 2004, (polyphag auf 20 Arten S. 14 harte Fruchtkörper S. 15 entomologicafennica.org PDF).
- Johannes Reibnitz, Roman Graf, Armin Coray: Verzeichnis der Ciidae (Coleoptera) der Schweiz mit Angaben zur Nomenklatur und Ökologie in Mitteilungen der Schweizerischen Entomologischen Gesellschaft 86, S. 63–88, 2013 (S. 82 Nr. 40 PDF).
- Johannes Reibnitz: Verbreitung und Lebensräume der Baumschwammfresser Süddeutschlands (Coleoptera, Cisidae). In: Mitteilungen des Entomologischen Vereins Stuttgart. S. 13 Tab. 5, zobodat.at [PDF]
- Bjørn Arne Rukke: Effects of habitat fragmentation: increased isolation and reduced habitat size reduces the incidence of dead wood fungi beetles in a fragmented forest landscape. In: Ecography. Band 23, Nr. 4, August 2000, ISSN 1600-0587, S. 492–502, doi:10.1111/j.1600-0587.2000.tb00305.x.
- Mats Jonsell, Göran Nordlander: Field attraction of Coleoptera to odours of the wood-decaying polypores Fomitopsis pinicola and Fomes fomentarius in Ann. Zool. Fennici. 32, Helsinki, 8. Dez. 1995, ISSN 0003-455X, S. 391–402 hier S. 396 (annzool.net PDF).
- Bjørn Arne Rukke: Fungivorous beetles in basidiocarps of Fomes fomentarius respond differently to microhabitat variables. In: Eur. J. Entomol. 99, S. 43–52, 2002 ISSN 1210-5759 Höhe über Grund S. 45 (eje.cz PDF).
- T.-E. Fossli, J. Anderson: Host preference of Cisidae (Coleooptera) on tree-inhabiting fungi in Northern Norway. In: Entomol Fennica. 9, S. 65–78. Abstract
- Mats Jonsell, Göran Nordlander: Host selection patterns in insects breeding in bracket fungi. In: Ecological Entomology. Band 29, Nr. 6, 2004, ISSN 1365-2311, S. 697–705, doi:10.1111/j.0307-6946.2004.00654.x/abstract.
- Mats Jonsell, Clara González Alonso, Mattias Forshage, Cees van Achterberg, Atte Komonen: Structure of insect community in the fungus Inonotus radiatusin riparian boreal forests. In: Journal of Natural History. Band 50, Nr. 25–26, 2016, ISSN 0022-2933, S. 1613–1631, hier S. 11, doi:10.1080/00222933.2016.1145273 (researchgate.net [PDF]).
- I. Hanski: Fungivori–Fungi, Insects and Ecology. In: N. Wildling, N. M. Collins, P. M. Hammond, J. F. Webber (Hrsg.): Insect-Fungus interactions. Academic Press 1989, ISBN 0-12-751800-2, S. 40 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- Dmitry S. Schigel et al.: Polypores and associated beetles of the north Karelian Biosphere Reserve, eastern Finland. In: Karstenia. 44, S. 35–56, 2004 Abstract, hier S. 54/55 (PDF; 987 kB).
- Michał Sawoniewicz: Seasonal dynamics of saproxylic beetles (Coleoptera) occurring in decaying birch (Betula spp.) wood in the Kampinos National Park. In: Leśne Prace Badawcze (Hrsg.): Forest Research Papers. Band 76, Nr. 3. De Gruyter Open, September 2015, ISSN 2082-8926, S. 213–220, hier 215, doi:10.1515/frp-2015-0020 (degruyter.com [PDF]).