Ebolafieber
Ebolafieber, nach ICD-10 Ebola-Viruskrankheit, ist eine Infektionskrankheit, die durch Viren der Gattung Ebolavirus hervorgerufen wird. Die Bezeichnung geht auf den Fluss Ebola in der Demokratischen Republik Kongo zurück, in dessen Nähe diese Viren 1976 den ersten allgemein bekannten großen Ausbruch verursacht hatten. Von 2014 bis 2016 gab es die weltweit bislang schwerste Ebolafieber-Epidemie in Westafrika.[1]
| Klassifikation nach ICD-10 | |
|---|---|
| A98.4 | Ebola-Viruskrankheit |
| ICD-10 online (WHO-Version 2019) | |
Das Ebolafieber ist eine Zoonose und verläuft je nach Virusart in etwa 25 bis 90 % aller Fälle tödlich, wobei die durchschnittliche Fallsterblichkeitsrate bei 50 % liegt.[2] Als Therapie stehen bislang Maßnahmen zur Bekämpfung oder Linderung einzelner Krankheitssymptome zur Verfügung. Zur Prophylaxe werden Impfungen genutzt. In Deutschland, Österreich, der Schweiz und in vielen anderen Ländern besteht eine Meldepflicht bei Verdacht auf Ebolafieber, bei direktem oder indirektem Erregernachweis, bei Ausbruch der Erkrankung, beim hämorrhagischen Krankheitsverlauf oder bei Tod durch die Ebola-Virus-Krankheit. Für die Erkrankung von Affen besteht in Deutschland Anzeigepflicht nach dem Tiergesundheitsgesetz (TierGesG).[3]
Ursache


Es werden fünf Arten in der Gattung Ebolavirus unterschieden: Zaire-Ebolavirus (EBOV), Sudan-Ebolavirus (SUDV), Reston-Ebolavirus (RESTV), Taï-Forest-Ebolavirus (TAFV, früher Elfenbeinküste- bzw. Côte-d’Ivoire-Ebolavirus) und Bundibugyo-Ebolavirus (BDBV). Außer dem Reston-Ebolavirus lösen alle anderen vier Arten beim Menschen hohes Fieber über 38,5 °C in Verbindung mit Blutungen (hämorrhagisches Fieber) aus. Die Sterblichkeit (Letalität) der Erkrankten durch Ebolafieber liegt bei 50 bis 90 % im Falle von EBOV, bei 41 bis 65 % im Falle von SUDV sowie bei 25 und 36 % bei den beiden bekannten Ausbrüchen des BDBV. Im Falle des TAFV und RESTV ist kein Toter unter den wenigen nachgewiesenen Erkrankungsfällen.[4] Die Weltgesundheitsorganisation (WHO) gibt eine case fatality rate (Letalitätsrate) von rund 50 % an, mit einer Spannweite von 25 bis 90 % bei den vergangenen Ausbrüchen.[2] Das Robert Koch-Institut nennt eine Letalität je nach Virusspezies von 30 bis 90 %.[5] Aufgrund der hohen Letalität und Infektionsgefahr wird der Erreger in die höchste Risikogruppe 4 nach der Biostoffverordnung eingeordnet (lediglich die Virusspezies RESTV ist der Risikogruppe 2 zugeordnet).
Das natürliche Reservoir des Virus – der Reservoirwirt – ist bislang unbekannt.[6] Es gibt jedoch Hinweise darauf, dass als Hauptwirt Nilflughunde in Frage kommen. In jüngster Zeit konnten Forscher aus dem Centre International de recherches Médicales de Franceville in Gabun entweder Virusbruchstücke oder Virusantikörper in sechs selbst nicht erkrankten Flughundearten nachweisen. Es handelte sich dabei um die Flughundearten Epomops franqueti, Hammerkopf (Hypsignathus monstrosus), Schmalkragen-Flughund (Myonycteris torquata), Micropteropus pusillus und Nilflughund (Rousettus aegyptiacus) sowie die Fledermausart Angola-Bulldoggfledermaus Mops condylurus aus einer Gegend, in der zuvor Schimpansen und Gorillas an Ebolafieber verendet waren.[7] In Teilen West- und Zentralafrikas werden diese Tiere als „Buschfleisch“ verzehrt. Es wird hinsichtlich dieses rohen Fleisches daher vom ungeschützten Kontakt und Verzehr abgeraten.[8][9]
Der Subtyp Reston löst bei der Affengattung der Makaken die Krankheit aus. Eine Krankheitsauslösung beim Menschen wurde jedoch bislang nicht festgestellt.[10]
Krankheitsentstehung
Übertragung
Der Erreger kann von erkrankten Menschen (durch Körperflüssigkeiten), von Tieren (einschließlich des regional üblichen „Buschfleischs“) und von kontaminierten Gegenständen auf den Menschen übertragen werden. Grundsätzlich lassen sich diese Infektionswege primär durch Desinfektion von Gegenständen und Verzicht auf „Buschfleisch“, sekundär durch Isolierung der Erkrankten und Schutzkleidung für pflegende Angehörige und medizinisches Personal zuverlässig ausschalten. Nicht in allen Gegenden sind allerdings hierfür die nötigen Voraussetzungen erfüllt.

Faktoren der Pathogenese
Im Rahmen der Ebolafieber-Epidemie 2014 bis 2016 in Westafrika wurde auch die Möglichkeit in Betracht gezogen, dass eine infizierte Person beispielsweise nach Europa einreist und erst dort erkrankt. Das Robert Koch-Institut (RKI) hat wichtige Faktoren genannt, die bei der Pathogenese von Bedeutung sind. Das dazu verwendete Flussschema soll dem medizinischen Personal als Hilfestellung dienen, einen begründeten Verdacht auf einen importierten Ebolafieber-Fall schnell zu erkennen.[5][11] Ähnliche Zusammenfassungen wurden ebenso von den Centers for Disease Control and Prevention (CDC) angewendet.[12]
Demnach handelt es sich um einen begründeten Verdachtsfall, wenn
- der Patient Fieber über 38,5 °C hat oder eine erhöhte Temperatur aufweist mit Begleitsymptomen wie Durchfall, Übelkeit, Erbrechen oder Hämorrhagien (vergleiche Symptome)
und in den 21 Tagen vor dem Erkrankungsbeginn einer der folgenden drei Punkte zutrifft:
- Kontakt mit einer Person, die an Ebolafieber erkrankt, krankheitsverdächtig oder an der Infektion verstorben war, wobei der Kontakt zu der Person ein unterschiedliches Expositionsrisiko aufweisen kann,
- beruflich Kontakt mit Ebolaviren, erregerhaltigem Material oder infizierten Tieren hatte, der Kontakt kann im Inland oder Ausland erfolgt sein oder
- Kontakt zu bestimmten Tieren, die Ebolaviren übertragen können (Flughunde, Fledermäuse, Primaten), oder Kontakt zu deren Ausscheidungen in einem von Ebolafieber-Ausbrüchen betroffenen Gebiet in Afrika oder Kontakt zu „Bushmeat“ aus diesen Gebieten hatte.

Inkubationszeit
Hinsichtlich der Inkubationszeit wurden verschiedene Angaben veröffentlicht.[13][14] Im Allgemeinen wird sie mit 2 bis 21 Tagen angegeben,[2][15] am häufigsten beträgt sie 8 bis 10 Tage.[6] In 3 % aller Fälle sind es 22 bis 42 Tage, in 2 % der Fälle macht die WHO keine Aussagen.[16]
Klinische Erscheinungen
Bei vielen Patienten lassen sich zwei klinische Phasen der Erkrankung unterscheiden,[17] zwischen denen die Symptome über 24 bis 48 Stunden abklingen (Remission). In der ersten Phase treten Symptome wie bei einer beginnenden Grippe auf, die zweite Phase ist durch hämorrhagisches Fieber gekennzeichnet.[18]
Nach Ablauf der Inkubationszeit treten zunächst grippeähnliche Symptome auf, mit Fieber, Schüttelfrost, Kopf- und Muskelschmerzen, hinzu kommen Übelkeit und Erbrechen oder auch Durchfall.[17] Weitere Symptome, die während der Epidemie in Mosango (Demokratische Republik Kongo) 1995 dokumentiert wurden, sind Kraftlosigkeit, Schmerz im Unterleib, Appetitlosigkeit, Gelenkschmerz, Rötung der Schleimhäute in der Mundhöhle, Schluckstörung und Bindehautentzündung.[18] Darüber hinaus wurden bei der Epidemie 2014 im Kenema-Staatskrankenhaus (Sierra Leone) noch Schwindelanfälle, Halsschmerzen und Ödeme als Symptome dokumentiert.[19] Ein Hautausschlag entwickelt sich bei rund einem Viertel bis der Hälfte der Patienten.[17] Nach wenigen Tagen der symptomatischen Erkrankung weisen einige Patienten Blutungen auf. Diese beschränken sich meist auf Hautblutungen wie Petechien, Ekchymosen, Konjunktivalblutungen (Blutungen in der Bindehaut des Auges) oder Blutungen nach Nadeleinstichen, wie bei Injektionen.[17]
Die Dokumentation der Symptome von Ebolafieber-Patienten im Kenema-Staatskrankenhaus in Sierra Leone während der Epidemie 2014 ermöglicht Aussagen über die Häufigkeit der Symptome, dabei ist jedoch zu beachten, dass nur die Daten von 44 Patienten erfasst wurden. Hiernach weisen viele Erkrankte Fieber (89 % der Patienten), Kopfschmerz (80 %), Kraftlosigkeit (66 %), Schwindelanfälle (60 %) und Durchfall (51 %) auf. Weniger häufig auftretende Symptome sind Unterleibsschmerz (40 %), Halsschmerz (34 %), Erbrechen (34 %) und Konjunktivitis (31 %). Bei nur einem Patienten wurden Blutungen dokumentiert, so dass für die Epidemie 2014 hämorrhagische Symptome als selten angesehen werden. Allerdings können diese bei den verbleibenden 43 Patienten nicht ausgeschlossen werden, da eingeschränkt protokolliert wurde.[19]
Die zweite Phase der Erkrankung ist durch hämorrhagisches Fieber gekennzeichnet, hohes Fieber mit mehr als 38,5 °C in Verbindung mit Blutungen.[18] Die Patienten weisen in diesem späteren und schwereren Krankheitsverlauf Schleimhautblutungen vor allem aus dem Magen-Darm-Trakt auf,[17] aber auch aus anderen Organen, z. B. der Niere,[18] was sich durch blutigen Stuhl und Urin äußert. Bei den Patienten zeigen sich Schockzustände und Kreislaufzusammenbrüche.[17] Die Beeinträchtigung der Nieren führt zu Oligurie und schließlich zum Nierenversagen.[18] Auch über neuropsychiatrische Auffälligkeiten wurde berichtet, bei dem Ausbruch von 1995 wurden Krämpfe (Konvulsionen) und Delirium diagnostiziert.[18] Während der Epidemie 2014 wurde außerdem von Verwirrtheit und Hörverlust berichtet.[19] Bei tödlichen Verläufen wird der Tod durch eine Form des septischen Schocks mit multiplem Organversagen hervorgerufen. Durch Obduktionen lassen sich Schädigungen (Nekrosen) an verschiedenen Organsystemen nachweisen, ohne dass sich im Regelfall eine einzelne pathologische Veränderung als Todesursache bestimmen lässt.[17]
Untersuchungsmethoden
Klinisch ist eine Ebolainfektion in ihrem Erscheinungsbild nicht eindeutig von einer Infektion mit dem Marburg-Virus oder anderen Viren, die hämorrhagisches Fieber auslösen, unterscheidbar.
Diagnose
Das Virus kann nur durch Labordiagnostik im Blut, im Urin oder im Speichel zweifelsfrei nachgewiesen werden. Als Standardverfahren hat sich die Reverse Transkriptase-PCR etabliert, bei der bereits sehr wenige Viruskopien für einen sicheren Nachweis ausreichen. Auch ein Nachweis der speziellen Antikörper ist möglich, allerdings werden diese häufig erst im späteren Verlauf der Erkrankung gebildet, ihre Abwesenheit kann daher nicht als Ausschlusskriterium einer akuten Infektion gelten.[2][5] Der Umgang mit Ebolaviren darf nur in Hochsicherheitslaboren der Schutzstufe 4 erfolgen.
Differenzialdiagnose
In der Differenzialdiagnose sind andere Tropenkrankheiten auszuschließen, die sich auch durch Fieber äußern können. Dies trifft häufig auf Malaria zu. Weiterhin muss abgeklärt werden, ob es sich nicht um einen Fall von viral hervorgerufenem hämorrhagischen Fieber jenseits von Ebolafieber handelt. Dies ist beispielsweise Denguefieber (verursacht durch das Dengue-Virus), Gelbfieber (verursacht durch das Gelbfieber-Virus), Krim-Kongo-Fieber (verursacht durch das Krim-Kongo-Hämorrhagisches-Fieber-Virus), Lassafieber (verursacht durch das Lassa-Virus), Marburgfieber (verursacht durch das Marburg-Virus) oder Infektionskrankheiten verursacht durch Hantaviren oder das Hepatitis-A-Virus. Ebenso müssen bakterielle Erkrankungen ausgeschlossen werden, wie beispielsweise Typhus abdominalis, Pest, Rickettsiose, Meningokokken-Sepsis oder andere Sepsisformen, Leptospirose, Bakterienruhr oder hämorrhagische Formen des Rückfallfiebers.[5]
Behandlung
Therapie
.jpg.webp)
Zur Behandlung wird eine symptomatische Therapie durchgeführt. Im Frühstadium gibt es vereinzelt Erfolge mit Rekonvaleszentenserum. Ein wirksames Virostatikum ist bisher nicht bekannt, Ribavirin zeigt gegen Filoviren keine Wirkung. Die Isolierung der Patienten ist von großer Bedeutung, um eine Infektion des medizinischen Personals oder anderer Patienten zu verhindern. Die symptomatische Therapie beinhaltet eine intensivmedizinische Betreuung, bei der fiebersenkende Maßnahmen, Ausgleich des Flüssigkeits- und Elektrolytverlustes sowie Regulierung des Glucosehaushalts im Mittelpunkt stehen.[5]
Im Zuge der Ebolaepidemie 2014 erfolgte erstmals die Behandlung von zwei US-amerikanischen Infizierten mit einem experimentellen Antikörper. Der Name des nicht zugelassenen Medikaments der Firma Mapp Biopharmaceutical aus San Diego lautet ZMapp. Es wurde erfolgreich an einigen Affen getestet und zeigte bei den beiden US-Amerikanern deutliche Verbesserungen innerhalb weniger Stunden.[20]
Neben den Impfungen werden bei der Behandlung während der Ebolafieber-Epidemie seit 2018 im Ostkongo gezielt und von klinischen Studien begleitet in der Behandlung des Ebolafiebers noch nicht etablierte Medikamente experimentell therapeutisch eingesetzt. Dabei kommen vier medikamentöse Therapien zum Einsatz. Bei zweien werden medikamentös Antikörper eingesetzt und bei den anderen beiden wird mit antiviralen Medikamenten behandelt. Im Juli 2019 war noch nicht abzuschätzen, wie gut diese neuen Therapien wirken, da noch keine belastbaren Zahlen vorlagen, wie viele Patienten behandelt wurden und wie das Outcome oder die Überlebensraten bei den entsprechend behandelten Patienten jeweils war.[21]
Mit Ebola-Virus infizierte Rhesusaffen und Makaken konnten noch bis zu 5 Tagen nach der Infektion durch den Einsatz stabiler gegen das L-Protein der RNA-Polymerase, das Virusprotein 24 und das Virusprotein 35 des Ebola-Virus gerichteter kurzer eingreifender Ribonukleinsäuremoleküle, sogenannter small interfering RNA (siRNA), gerettet werden. Von den mit siRNA behandelten 3 Rhesusaffen überlebten 2, von den 7 Makaken überlebten alle.[22][23]
Behandlungseinrichtungen

An folgenden deutschen Kliniken werden Sonderisolierstationen für hochinfektiöse Patienten vorgehalten:[24]
- Charité Campus CVK in Berlin
- Universitätsklinikum Düsseldorf
- Universitätsklinikum Frankfurt am Main
- Universitätsklinikum Hamburg-Eppendorf (UKE)
- Klinikum St. Georg Leipzig
- Klinikum Schwabing in München
- Robert-Bosch-Krankenhaus in Stuttgart
- Missionsärztliches Institut in Würzburg (derzeit allerdings keine Akutbehandlung möglich)
In Österreich verfügt die Klinik Favoriten in Wien über eine Sonderisolierstation.[25]
Im Rahmen der Ebolafieber-Epidemie 2014 wurden Infizierte am UKE in Hamburg, am Universitätsklinikum in Frankfurt am Main und am Klinikum St. Georg in Leipzig behandelt. Nach Angaben des Universitätsklinikums in Hamburg-Eppendorf können dort bis zu sechs Patienten gleichzeitig auf der Sonderisolierstation behandelt werden. Für die Betreuung eines infizierten senegalesischen Labormitarbeiters wurden 50 Pflegekräfte und 30 Ärzte geschult.[26] Auch das Frankfurter Klinikum gab an, bis zu sechs Patienten gleichzeitig auf der Sonderisolierstation aufnehmen zu können.[27]
Heilungsaussicht
Prognose
Ebolafieber verläuft oft tödlich. Die Todesrate variierte je nach Ausbruch und Virusvariante zwischen 25 und 90 %[2] (siehe Ursache). Ein laborchemischer Prädiktor ist die Menge der durch PCR im Blut nachgewiesenen Virus-RNA. Bei Patienten, welche schließlich an der Krankheit verstarben, war diese um den Faktor 100 (rund 2 Log-Stufen) höher.[28][19] An der Spezies Zaire-Ebolavirus konnte nachgewiesen werden, dass bei Überlebenden des Virus eine gut regulierte Immunantwort auf das Virus stattfindet, während bei Todesopfern eine defiziente Immunantwort mit einer Überaktivierung an Makrophagen und Monozyten vorherrscht. Als Marker für das Überleben wurden Interleukin-1β (IL-1β) und Interleukin-6 (IL-6) identifiziert. Als Marker für eine defiziente Immunantwort konnten Interleukin-10 (IL-10), IL1RA und Neopterin identifiziert werden.[29] Bezüglich der klinischen Erscheinungen ist das Auftreten von Fieber und die Höhe der Körpertemperatur nicht für die Vorhersage des Krankheitsverlaufs geeignet.[19]
Zeitlicher Verlauf
Während der Epidemie 2014 wurden am Kenema-Staatskrankenhaus in Sierra Leone Daten zum zeitlichen Verlauf der Krankheit aufgezeichnet. Dabei handelt es sich um eine kleine Gruppe von Patienten, je nach Art des Aufzeichnungszeitpunktes zwischen 39 und 63 Patienten. Die Angaben erfolgen als Mittelwert plus bzw. minus Standardfehler. Demnach vergingen 5,7 ± 0,5 Tage vom Auftreten der ersten Symptome bis zur Einweisung bzw. Aufnahme im Krankenhaus. Bei Patienten, bei denen die Ebola-Viruskrankheit tödlich verlief, lagen 9,8 ± 0,7 Tage zwischen dem Auftreten der ersten Symptome und dem Tod. Bei den Patienten, die die Krankheit überlebten, vergingen 21,3 ± 2,6 Tage zwischen dem Auftreten der ersten Symptome und der Entlassung aus dem Krankenhaus.[19][30]
Folgeerkrankungen
Wird die Erkrankung überlebt, können in der Rekonvaleszenz Komplikationen auftreten – beschrieben wurden Psychosen, Myelitis (Rückenmarksentzündung), Hepatitis (Leberentzündung) und Uveitis (Regenbogenhautentzündung).[31] Die Rückenmarksentzündung kann wiederum zu einer Querschnittlähmung führen.
Präventions- und Bekämpfungsmaßnahmen
Präventionsmaßnahmen während der Behandlung
Begleitend zur Behandlung infizierter Patienten sind auch Reinigungs- und Desinfektionsmaßnahmen anzuwenden, um die Übertragung durch kontaminierte Gegenstände und Oberflächen zu unterbinden. Dies dient dem Schutz des medizinischen Personals oder der Angehörigen. Das Robert Koch-Institut empfiehlt für die Desinfektion von Oberflächen wie auch für die Händedesinfektion Mittel mit dem Wirkungsbereich „begrenzt viruzid“ bzw. „viruzid“.[5] Listen mit geeigneten Desinfektionsmitteln sind beim RKI[32] oder beim Verbund für Angewandte Hygiene (VAH)[33] erhältlich. Für den Fall eines möglichen Kontakts mit dem Virus sind zur postexpositionellen Prophylaxe (PEP) Maßnahmen zur Haut- und Schleimhautdesinfektion nötig. Nach Angaben des RKI sollte analog der Deutsch-Österreichischen Leitlinien zur HIV-PEP vorgegangen werden.[5][34] Ebenso muss das medizinische Personal über eine persönliche Schutzausrüstung verfügen (siehe Übertragung des Ebolavirus).[5]
Umgang mit Erkrankten und Krankheitsverdächtigen
Bei Patienten, die möglicherweise an Ebolafieber erkrankt sind, ist umgehend zu prüfen, ob es sich um einen begründeten Verdachtsfall handelt (siehe Abschnitt Faktoren der Pathogenese). Das Robert Koch-Institut empfiehlt, den Patienten bis zur Entscheidung im derzeitigen Umfeld zu belassen, weitere Personen (medizinisches Personal oder Angehörige) sollen einen Mindestabstand von einem Meter einhalten oder Schutzkleidung tragen. Sobald klar ist, dass es sich um einen begründeten Verdachtsfall handelt, soll die Isolierung des Patienten in einem dafür eingerichteten Behandlungszentrum erfolgen. Die Infektion ist durch eine Labordiagnostik zu bestätigen. Falls der Zustand des Patienten eine sofortige Behandlung erfordert, darf er in ein Krankenhaus der Regelversorgung eingewiesen werden, unter Beachtung der Regeln des Barrier Nursing (übersetzt etwa „Krankenpflege mit Absperrung“).[5] Das Prinzip des „Barrier Nursing“ ist die Beachtung von drei Zonen beim Umgang mit hoch kontagiösen Krankheitserregern. Im ersten Bereich erfolgt die Behandlung des Patienten, hier muss Schutzkleidung getragen werden. Das Zimmer oder die Station ist nur über einen Schleusenbereich zu betreten. In dieser zweiten Zone erfolgt die Dekontamination der Schutzkleidung nach Verlassen des Behandlungsraums, um Infektionen zu vermeiden. Im dritten Bereich findet die Unterstützung des medizinischen Personals statt.[35] Bei Transportfähigkeit ist die Verlegung in ein Kompetenz- und Behandlungszentrum anzustreben.[5]
Weiterhin müssen alle Kontaktpersonen gefunden werden, die direkten Kontakt mit dem Erkrankten hatten oder mit infektiösem Material des Erkrankten in Kontakt gekommen sind. Das Gesundheitsamt ermittelt die Kontaktpersonen und übernimmt eine Einschätzung ihres Expositionsrisiko.[5] Nach dem deutschen Infektionsschutzgesetz (IfSG) kann dabei unter anderem eine Beobachtung (§ 29 IfSG) oder eine Quarantäne (§ 30 IfSG) angeordnet werden. Durch diese Schutzmaßnahmen (§ 28 IfSG) soll die Verbreitung übertragbarer Krankheiten verhindert werden, sie stellen einen zulässigen Eingriff in die im Grundgesetz für die Bundesrepublik Deutschland festgelegten Grundrechte (z. B. Freiheit der Person) dar. Nach den Empfehlungen des RKI soll bei Kontaktpersonen 21 Tage (Inkubationszeit) lang regelmäßig überwacht werden, ob klinische Erscheinungen (insbesondere Fieber) oder unspezifische Symptome auftreten. Wenn dies der Fall ist, gelten die für begründete Verdachtsfälle beschriebenen Maßnahmen.[5]
Maßnahmen im Umfeld
Das Umfeld der Patienten ist bei Bestätigung eines Ebolafieberfalls zu desinfizieren, dies gilt beispielsweise für die Wohnung der Person oder Bereiche, in denen die Behandlung stattgefunden hat.[5] Die Rechtsgrundlage in Deutschland für diese „besonderen Maßnahmen“ ist § 17 IfSG. Für den Umgang mit Haustieren von an Ebolafieber Erkrankten gibt es zurzeit keine Empfehlung des RKI. Für die USA wurden im Rahmen der Ebolafieber-Epidemie 2014 Empfehlungen durch die CDC veröffentlicht.[36] Im Fall der in Spanien im Oktober 2014 infizierten Krankenschwester wurde ihr Hund vorsorglich getötet.[37]
Das Robert Koch-Institut hat ein Merkblatt mit detaillierten Informationen über Desinfektionsmaßnahmen bei einem begründeten Ebolafieber-Verdachtsfall veröffentlicht. Darin wird unter anderem auch die Wäschedesinfektion beschrieben. Während der Behandlung der Patienten sollte Einmalwäsche verwendet werden. Diese, aber auch Kleidungsstücke und sonstige Wäsche des Erkrankten, die möglicherweise kontaminiert sind, müssen einer geeigneten Abfallentsorgung zugeführt werden.[38]
Alle Abfälle, welche bei der Versorgung eines begründeten Ebolafieber-Verdachtsfalls anfallen, müssen durch eine fachgerechte Abfallentsorgung inaktiviert werden.[38] Neben dem Infektionsschutzgesetz sind auch die Vorgaben der Biostoffverordnung (BioStoffV) zu beachten, insbesondere die in Anhang II BioStoffV festgelegten Schutzmaßnahmen für die Schutzstufen 2, 3 und 4. Diese Schutzmaßnahmen sind für Einrichtungen des Gesundheitsdienstes zwar nicht direkt vorgeschrieben, der Arbeitgeber hat jedoch geeignete Maßnahmen daraus auszuwählen, um Beschäftigte und andere Personen zu schützen (§ 11 BioStoffV). Üblicherweise sind kontaminierte feste und flüssige Abfälle vor der endgültigen Entsorgung durch physikalische oder chemische Verfahren zu inaktivieren (Anhang II 1 zur BioStoffV).
In amerikanischen Krankenhäusern fallen pro Patient und Tag typischerweise 8 Fässer mit je 250 Liter Fassungsvermögen an Sondermüll an, da sämtliche Materialien, die in die Nähe des Patienten gelangt sind, entsorgt werden müssen.[39]
Maßnahmen bei Todesfällen
Auch für den Fall, dass ein an Ebolafieber Erkrankter stirbt, existieren RKI-Empfehlungen. Wenn eine Obduktion erforderlich ist, soll sie nur unter Bedingungen der Schutzstufe 4 durch besonders qualifiziertes Personal erfolgen. Der Leichnam wird in eine flüssigkeitsdichte Plastikhülle überführt, die in einen verschließbaren und von außen desinfizierten Sarg gelegt wird. Dessen Aufbewahrung muss in einem gesicherten und entsprechend gekennzeichneten Bereich, vorzugsweise einem Kühlraum, erfolgen. Die Bestatter sind über das Infektionsrisiko bei ungeschütztem Kontakt mit dem Leichnam zu informieren. Eine Feuerbestattung (Kremation) wird empfohlen.[5]
Immunität
Eine serologische Untersuchung von 4349 Menschen in Gabun zeigt eine hohe Prävalenz von Antikörpern gegen die Virusspezies Zaire-Ebolavirus (früher als ZEBOV, aktuell als EBOV abgekürzt). Mit Hilfe des ELISA-Verfahrens wurden Blutproben untersucht, und bei 15,3 % der Proben wurde ein gegen EBOV gerichtetes Immunglobulin G (IgG) nachgewiesen. Weitere Untersuchungen zeigen, dass es sich um eine humorale und eine zelluläre Immunantwort handelt. Die untersuchten Personen leben sowohl in Gebieten, in denen es bereits Ausbrüche von Ebolafieber gab, wie auch in Gebieten, in denen bisher keine Erkrankungen registriert wurden. Eine Schlussfolgerung der Studie ist, dass sie durch Kontakt mit dem Virus eine Immunität erlangt haben, ohne dass bei ihnen die Infektionskrankheit Ebolafieber diagnostizierbar war. Der Kontakt zu Wildtieren als Wirt ist eine Möglichkeit für einen Kontakt mit dem Ebolavirus, erklärt jedoch nicht die hohe Prävalenz. Stattdessen wird angenommen, dass die Personen über Früchte, die mit dem Speichel der entsprechenden Tiere, wie z. B. Fledermäusen kontaminiert waren, mit dem Virus in Berührung gekommen sind. Die Frage, ob ein Mensch durch eine überstandene Ebolafieber-Erkrankung zumindest gegen die infektionsauslösende Ebolavirus-Spezies immun ist, wird durch die Studie nicht geklärt.[40]
Impfung

Spätestens seit 2012 wird an der Entwicklung von Ebola-Impfstoffen gearbeitet; manche haben sich im Tierversuch sogar bei der Gabe zwei bis drei Tage nach der Infektion noch bewährt und zu einer Heilung geführt.[41] Inzwischen wurde einer von ihnen, rVSV-ZEBOV (Ervebo), auch in Europa, den USA und einigen Ländern Afrikas zugelassen.[42]
Ab September 2014 wurde erstmals ein Impfstoff gegen das Ebolavirus von den National Institutes of Health der Vereinigten Staaten auf seine Verträglichkeit an zwanzig gesunden Probanden geprüft. Der Impfstoff besteht aus einem Schimpansen-Adenovirus, dem zusätzlich gentechnisch ein Ebola-Virusprotein eingepflanzt wurde, das eine Immunantwort auslöst. Das Schimpansen-Adenovirus wurde als Vehikel für das Ebola-Virusprotein ausgewählt, da es normalerweise keine Erkrankung beim Menschen auslöst. Der Impfstoff wurde von der schweizerisch-italienischen Biotechfirma Okairos entwickelt, die im Jahr 2013 vom Pharmakonzern GlaxoSmithKline übernommen wurde.[43]
In Kanada wird ebenfalls an der Entwicklung eines Impfstoffs gearbeitet. Das experimentelle Präparat namens VSV-EBOV, ein Präparat aus dem vesikulären Stomatitis-Virus mit Ebola-Antigenen, wurde im staatlichen Canadian National Microbiology Laboratory entwickelt und bereits erfolgreich an Affen getestet.[44] Im Oktober 2014 begannen Tests an Menschen, in der Versuchsphase wird das Mittel 40 gesunden, freiwilligen Probanden in den USA verabreicht. Außerdem stellte die kanadische Regierung den experimentellen Impfstoff der WHO zur Verfügung.[45]
Ende 2016 wurde berichtet, dass der Wirkstoff rVSV-ZEBOV der Firma Merck, Sharp & Dohme (MSD) laut WHO als erster Impfstoff wirksam und sicher abschließend klinisch getestet wurde.[46] Der Wirkstoff wurde erstmals in Guinea gegen Ende der 2014 ausgebrochenen Ebolafieber-Epidemie eingesetzt. Im Sommer 2018 kam es in der Demokratischen Republik Kongo zu erneuten Ausbrüchen des Ebolafiebers; daraufhin begann die Regierung eine Impfkampagne,[47] bei der bis zum November 2018 mehr als 28.000 Menschen der Wirkstoff rVSV-ZEBOV verabreicht wurde.[48] Die Effektivität soll bei etwa 97 % liegen.[21] Im Oktober 2019 hat der Ausschuss für Humanarzneimittel (CHMP) der EMA eine Zulassungsempfehlung für den Impfstoff abgegeben.[49] Die in Studien ermittelte Effektivität schwankte für den zehnten Tag nach Impfung zwischen 97,5 und 100 %.[42]
Der in Russland entwickelte Wirkstoff GamEvac-Combi wurde dort in Studien der Phase I/II an 83 gesunden Erwachsenen getestet.[50] Seit August 2017 wird er in weiteren klinischen Studien an freiwillige Probanden in Guinea verabreicht; im April 2018[51] waren es mehr als 1000 Probanden.
Forschung
Wissenschaftlern des USAMRIID gelang es im Jahre 2003, Mäuse durch Injektion von virusähnlichen Partikeln zu immunisieren. Anfang 2005 zeigten Forscher um Steven Jones und Heinz Feldmann (University of Manitoba, Winnipeg, Kanada) eine erfolgreiche Impfung (aktive Immunisierung) bei Javaneraffen (Macaca fascicularis) mit einem abgeschwächten, lebenden, rekombinanten Vesiculären-Stomatitis-Virus (VSV), das auf seiner Oberfläche ein so genanntes Glycoprotein des Zaire-Ebolavirus-Stammes „Kikwit“ produziert. Nunmehr erhofft man sich eine baldige vorbeugende Impfmöglichkeit auch beim Menschen.
Forscher des US-Militärs haben 2010 ein Medikament, das die Virusreplikation hemmt, indem es sich an die RNA des Virus bindet, erfolgreich an Affen getestet. Dabei überlebten 60 % der Rhesusaffen und 100 % der vorher infizierten Makaken.[52]
2011 verkündeten Forscher des Scripps Research Institute Erfolge mit einem von ihnen entwickelten Antikörper. „Forscher haben erstmals einen Antikörper entdeckt, der den tödlichen Sudan-Stamm des Ebolavirus außer Gefecht setzt. Der Antikörper verhindert, dass das Virus in das Innere der Zellen gelangt. Das eröffne eine Möglichkeit, einen Impfstoff gegen die Krankheit zu entwickeln, berichten Forscher im Fachmagazin Nature Structural & Molecular Biology.“[53]
Die Estrogenrezeptormodulatoren Clomifen und Toremifen hemmen die Ebolaerkrankung in infizierten Mäusen.[54] Laut einer Studie aus dem Jahr 2014 verhindert das Herzmittel Amiodaron das Eindringen von Ebolaviren in Zellen zumindest im Reagenzglas.[55][56]
Experimentelle Impfstoffe und Wirkstoffe sind z. B. ZMapp, cAd3-ZEBOV, TKM-Ebola, Favipiravir, Brincidofovir, JK-05, FGI-106 und BCX4430.
Ausbrüche
Dokumentiertes Auftreten und Epidemien der Ebola-Viruskrankheit
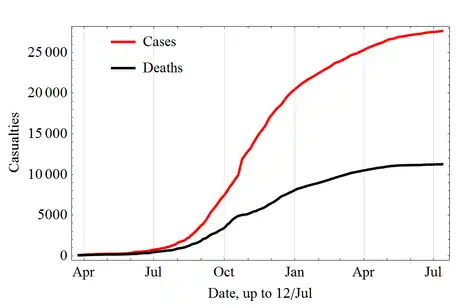 Ebola-Epidemie 2014/15 in Westafrika zwischen April 2014 und Juli 2015 (inkl. Verdachtsfälle) Erkrankungen Todesfälle
Ebola-Epidemie 2014/15 in Westafrika zwischen April 2014 und Juli 2015 (inkl. Verdachtsfälle) Erkrankungen Todesfälle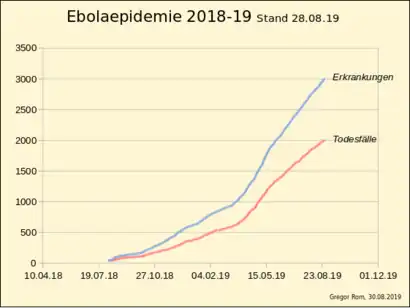 Ebola-Epidemie 2018/19 in der DR Kongo in den Provinzen Nord-Kivu und Ituri Gesamtzahl Erkrankungen Todesfälle
Ebola-Epidemie 2018/19 in der DR Kongo in den Provinzen Nord-Kivu und Ituri Gesamtzahl Erkrankungen Todesfälle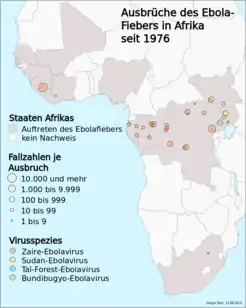 Dokumentierte Ausbrüche von Ebolafieber in Afrika (1976–2020)
Dokumentierte Ausbrüche von Ebolafieber in Afrika (1976–2020)
| Jahr | Land (heutiger Name) |
Virus- Typ |
Fälle | Tote | Letalität | Bemerkungen |
|---|---|---|---|---|---|---|
| seit 1976 | ||||||
| 1976 | Zaire (DR Kongo) | EBOV | 318 | 280 | 88 % | Aufgetreten in Yambuku im Bezirk Mongala im Norden des Zaire. Der Ausbruch der Krankheit wurde durch engen persönlichen Kontakt und durch die Verwendung von kontaminierten Nadeln und Spritzen in Krankenhäusern und Kliniken hervorgerufen.[57] |
| 1976 | Sudan (Südsudan) | SUDV | 284 | 151 | 53 % | Aufgetreten in Nzara und Maridi nahe Yambio. Die Krankheit wurde vor allem durch engen körperlichen Kontakt in den Krankenhäusern verbreitet. Zahlreiche Personen aus dem medizinischen Pflegepersonal wurden infiziert.[58] |
| 1976 | Vereinigtes Königreich | SUDV | 1 | 0 | 0 % | Labor-Infektion eines Angestellten in Birmingham durch eine Nadelstichverletzung.[59] |
| 1977 | Zaire (DR Kongo) | EBOV | 1 | 1 | 100 % | Berichtet wird über einen Ausbruch in Tandala in Süd-Ubangi.[60] |
| 1979 | Sudan (Südsudan) | SUDV | 34 | 22 | 65 % | Erneuter Ausbruch in Nzara und Maridi nahe Yambio wie im Jahr 1976.[61] |
| 1989 | USA | RESTV | 0 | 0 | – | Virus-Typ wurde bei importierten Affen von den Philippinen in den Quarantäneeinrichtungen in Virginia und Pennsylvania nachgewiesen.[62] |
| 1990 | USA | RESTV | 4 (asymptomatisch) | 0 | 0 % | Virus-Typ RESTV wurde erneut in Quarantäneeinrichtungen in Virginia und Texas festgestellt. Herkunft waren importierte Affen von den Philippinen. Vier Personen entwickelten Antikörper, aber erkrankten nicht.[63] |
| 1989/90 | Philippinen | RESTV | 3 (asymptomatisch) | 0 | 0 % | Hohe Sterblichkeit bei Javaneraffen in einer Primaten-Anlage. Die Tiere waren für den Export in die USA vorgesehen. Drei Tierpfleger entwickelten Antikörper, aber erkrankten nicht.[64] |
| 1992 | Italien | RESTV | 0 | 0 | – | In der Quarantäneeinrichtung in Siena wurden bei importierten Affen von den Philippinen der Typ RESTV festgestellt.[65] |
| 1994 | Gabun | EBOV | 52 | 31 | 60 % | Aufgetreten in Mékouka und weiteren Camps von Goldarbeitern im Regenwald in der Provinz Ogooué-Ivindo. Ursprünglich als Gelbfieber angesehen wurde dieser 1995 als Ebola-Ausbruch identifiziert.[66] |
| 1994 | Elfenbeinküste | TAFV | 1 | 0 | 0 % | Ein Wissenschaftler erkrankte nach einer Autopsie an einem wilden Schimpansen im Nationalpark Taï. Der Patient wurde in der Schweiz behandelt.[67] |
| 1995 | DR Kongo | EBOV | 315 | 254 | 81 % | Ausgebrochen in Kikwit und Umgebung in der Provinz Bandundu. Nach Recherchen erfolgte der Ausbruch bei Waldarbeitern und ein Ausbruch über die Angehörigen und in Krankenhäusern.[68] |
| Jan.–Apr. 1996 | Gabun | EBOV | 37 | 21 | 57 % | Ausgebrochen in Mayibout im Minkébé National Park. Ein getöteter Schimpanse wurde im Wald von Menschen auf der Jagd nach Nahrung gegessen. Neunzehn Menschen, die daran direkt beteiligt waren, erkrankten. Zudem traten weitere Fälle bei Familienangehörigen auf.[66] |
| Juli 1996–Jan. 1997 | Gabun | EBOV | 60 | 45 | 75 % | Ausgebrochen in Booué und Umgebung in der Provinz Ogooué-Ivindo und beim Patiententransport nach Libreville. Indexpatient war ein Jäger, der in einem Waldlager lebte. Die Krankheit wurde durch engen Kontakt mit infizierten Personen verbreitet.[66] |
| Nov. 1996 | Südafrika | EBOV | 2 | 1 | 50 % | Ein Mediziner reiste von Gabun nach Johannesburg, Südafrika, nachdem er in Gabun einen Ebola-Virus-infizierten Patienten behandelt hatte und dabei mit dem Virus in Kontakt gekommen war. Er wurde ins Krankenhaus eingeliefert, wobei sich eine Krankenschwester infizierte und verstarb.[69] |
| 1996 | USA | RESTV | 0 | 0 | – | Virus-Typ wurde bei importierten Affen von den Philippinen in den Quarantäneeinrichtungen in Texas nachgewiesen.[70] |
| 1996 | Philippinen | RESTV | 0 | 0 | – | Virus-Typ wurde bei Affen nachgewiesen, die für den Export in die USA vorgesehen waren.[71] |
| 1996 | Russland | EBOV | 1 | 1 | 100 % | Ein Todesfall nach einer Kontamination im Labor.[72] |
| seit 2000 | ||||||
| 2000–2001 | Uganda | SUDV | 425 | 224 | 53 % | Aufgetreten in Gulu, Masindi und Mbarara. Grund für die größere Verbreitung waren unzureichende Schutzmaßnahmen bei Begräbnissen von mit Ebola infizierten Patienten.[73] |
| Okt. 2001–März 2002 | Gabun | EBOV | 65 | 53 | 82 % | Ausbruch an der Grenze zur DR Kongo.[74] |
| Okt. 2001–März 2002 | DR Kongo | EBOV | 57 | 43 | 75 % | Ausbruch an der Grenze zu Gabun und erstmals in der Republik Kongo.[74] |
| Dez. 2002–Apr. 2003 | DR Kongo | EBOV | 143 | 128 | 89 % | Ausbruch in Mbomo und Kéllé im Département Cuvette-Ouest.[75] |
| Nov.–Dez. 2003 | DR Kongo | EBOV | 35 | 29 | 83 % | Ausbruch in Mbomo und im Dorf Mbandza im Département Cuvette-Ouest.[76] |
| 2004 | Sudan (Südsudan) | SUDV | 17 | 7 | 41 % | Ausbruch in Yambio.[77] |
| 2004 | Russland | EBOV | 1 | 1 | 100 % | Ein Todesfall nach einer Kontamination im Labor.[78] |
| 2005 | DR Kongo | EBOV | 81 | 11 | 13 % | Laut WHO Ausbruch in Etoumbi und Mbomo.[79] |
| Mai 2007 | DR Kongo | EBOV | 384 Verdachtsfälle | 167 | 43 % | Laut WHO Ausbruch in Kampungu, DR Kongo.[80][81] |
| Okt. 2007 | DR Kongo | EBOV | 264 | 187 | 71 % | Ausbruch in der Provinz Kasai-Occidental.[82] |
| Dez. 2007–Jan. 2008 | Uganda | BDBV | 149 | 37 | 25 % | Ausbruch im Distrikt Bundibugyo im Westen Ugandas.[83][84][85][86] |
| Nov. 2008 | Philippinen | RESTV | 6 (asymptomatisch) | 0 | 0 % | Erstes bekanntes Vorkommen des Ebola-Typs RESTV bei Schweinen. Sechs Arbeiter einer Schweinefarm und zur Verarbeitung von Schlachtabfällen bildeten Antikörper, erkrankten aber nicht.[87] |
| Dez. 2008–Feb. 2009 | DR Kongo | EBOV | 32 | 15 | 47 % | Laut WHO Ausbruch in Mweka und Luebo in der Provinz Kasai-Occidental.[88][89][90] |
| Mai 2011 | Uganda | SUDV | 1 | 1 | 100 % | Ausbruch in Ziroobwe in Distrikt Luwero, Uganda.[91] Andere Quellen geben Bombo, Uganda (35 km nördl. v. Kampala) an, 33 Menschen wurden vorsorglich isoliert.[92][93] |
| Juni–Okt. 2012 | Uganda | SUDV | 11 | 4 | 36 % | Ausbruch im Distrikt Kibaale, 11 Erkrankungsfälle und vier Todesfälle wurden laborbestätigt.[94] Die WHO berichtete von 50 Verdachtsfällen.[95][96] Andere Quellen geben 59 Verdachtsfälle an, 24 Menschen wurden vorsorglich isoliert.[97][98][99] |
| Juni–Nov. 2012 | DR Kongo | BDBV | 36 | 13 | 36 % | Ausbruch im Distrikt Haut-Uele der Provinz Orientale, DR Kongo.[100] 36 Erkrankungsfälle und 13 Todesfälle wurden laborbestätigt.[94] Die WHO berichtete von 46 Erkrankungsfällen (davon 14 laborbestätigt) und 19 Todesfällen (davon 6 laborbestätigt).[101] |
| Nov. 2012–Jan. 2013 | Uganda | SUDV | 6 | 3 | 50 % | Ausbruch im Distrikt Luwero, sechs Erkrankungsfälle und drei Todesfälle wurden laborbestätigt.[94] |
| Feb. 2014–Jan. 2016 | bis 17. Okt. 2014: Senegal bis 20. Okt. 2014: Guinea, Liberia, Sierra Leone, Nigeria bis 24. Nov. 2014: Mali bis 2. Dez. 2014: USA, Spanien | EBOV[102] | 28.635 | 11.314[103] | 60 % ⁽*⁾ | Ausbruch von hämorrhagischem Fieber seit dem 9. Februar 2014 in der Präfektur Macenta und Präfektur Guéckédou. Laut WHO, Gesundheitsministerium Guinea und Ärzte ohne Grenzen Vordringen bis zur Hauptstadt Conakry sowie nach Sierra Leone und Liberia.[104][105][106][107][108] Der Ausbruch in Nigeria Ende Juli 2014 ließ sich auf einen aus Liberia eingereisten Mann zurückführen, 20 Erkrankungs- und 8 Todesfälle wurden aus Lagos und Port Harcourt gemeldet. Der Ausbruch wurde am 20. Oktober 2014 für beendet erklärt.[109] Im Senegal wurde Ende August 2014 ein Fall bekannt, ein aus Guinea eingereister Mann. Da es keine weiteren Infektionen gab, wurde der Ausbruch am 17. Oktober 2014 für beendet erklärt.[110] Ende September 2014 gab es den ersten Fall in den USA (eingereist aus Liberia, verstorben).[111] Anfang Oktober 2014 wurde die erste Infektion in Spanien[112] und Infektionen in den USA (Ansteckung bei der Behandlung von Patienten) bekannt.[113] In Spanien gab es keine weiteren Infektionen, der Ausbruch wurde am 2. Dezember 2014 für beendet erklärt. Ende Oktober 2014 wurden der erste Fall in Mali (eingereist aus Guinea, verstorben) gemeldet.[103] ⁽*⁾ Die angegebene Letalitätsrate bezieht sich auf Fälle aus Guinea, Liberia und Sierra Leone, bei denen aufgrund von Aufzeichnungen rückverfolgbar ist, ob die infizierte Person verstorben ist oder geheilt wurde; diese Angaben sind nicht für die Gesamtzahl der gemeldeten Infektionen bzw. Todesfälle verfügbar.[103] |
| Aug.–Nov. 2014 | sty DR Kongo | EBOV, ähnlich dem in Kikwit 1995[114] | 66[115] | 49[115] | 74 % | Ausbruch in der Provinz Équateur.[116] Von Westafrika unabhängiger Ausbruch der Krankheit laut Gesundheitsminister Felix Kabange Numbi[117] und WHO.[114] Durch rasch eingeführte Präventions- und Kontrollmaßnahmen konnte dieser Ausbruch eingedämmt und am 21. November 2014 für beendet erklärt werden.[116] |
| Mai 2017 | DR Kongo | EBOV | 11 | 3 | 27 % | Ausbruch in der Provinz Bas-Uele.[118] |
| Mai–Juli 2018 | DR Kongo | EBOV | 54 | 33 | 61 % | Zwei Ebola-Fälle in Bikoro in der Provinz Équateur im Nordwesten des Kongo wurden am 8. Mai 2018 bestätigt.[119] 33 Todesfälle bis zum 4. August.[120] |
| (April?) Juli 2018 – Juni 2020[121] | DR Kongo, Uganda | EBOV | 3.481 | 2.299 | 66 % | Dokumentierte Erkrankungsfälle ab Juli 2018, wahrscheinlicher Ausbruch jedoch bereits im April 2018; bis Juni 2020 ausschließlich in den Provinzen Ituri, Nord-Kivu der Demokratischen Republik Kongo[122]; im Juni 2019 trat das Ebolafieber im Rahmen der Epidemie erstmals im benachbarten Uganda auf[123] |
| Juni–November 2020 | DR Kongo | EBOV | 128 | 55 | 43 % | Ausbruch in der Provinz Équateur[124] |
| Februar–Mai 2021 | DR Kongo | EBOV | 12 | 6 | 50 % | Ausbruch in der Provinz Nord-Kivu[125] |
| Februar–Juni 2021 | Guinea | EBOV | 23 | 12 | 52 % | Ausbruch in der Präfektur Nzérékoré[126] |
| Oktober-Dezember 2021 | DR Kongo | EBOV | 11 | 9 | 82% | Ausbruch in der Provinz Nord-Kivu[127] |
| April 2022 | DR Kongo | EBOV | 5 | 5 | 100% | Ausbruch in der Provinz Équateur[128] |
| August-September 2022 | DR Kongo | EBOV | 1 | 1 | 100% | Ausbruch in der Provinz Nord-Kivu[129] |
| Sep.2022-Jan. 2023 | Uganda | SUDV | 164 | 77 | 47% | Ausbruch in der Central Region, Western Region, Uganda[130] |
Legende:
- BDBV: Bundibugyo Virus (Spezies Bundibugyo Ebolavirus)
- EBOV: Ebola Virus (Spezies Zaire Ebolavirus)
- RESTV: Reston Virus (Spezies Reston Ebolavirus)
- SUDV: Sudan Virus (Spezies Sudan Ebolavirus) und
- TAFV: Taï Forest Virus (Spezies Taï Forest Ebolavirus)
Siehe auch: aktualisierte Nomenklatur der Spezies in der Gattung Ebolavirus
Epidemie 2014 in Westafrika
.gif)
 Regionale Verteilung der bestätigten und verdächtigen Erkrankungsfälle in Guinea, Liberia und Sierra Leone, Darstellung vom 25. August bis 12. Oktober 2014 (danach andere, nicht übertragbare Einteilung).[132]
Regionale Verteilung der bestätigten und verdächtigen Erkrankungsfälle in Guinea, Liberia und Sierra Leone, Darstellung vom 25. August bis 12. Oktober 2014 (danach andere, nicht übertragbare Einteilung).[132] Regionale Verteilung der bestätigten und verdächtigen Erkrankungsfälle in Guinea, Liberia und Sierra Leone, Darstellung ab 19. Oktober 2014 (davor andere, nicht übertragbare Einteilung).[132]
Regionale Verteilung der bestätigten und verdächtigen Erkrankungsfälle in Guinea, Liberia und Sierra Leone, Darstellung ab 19. Oktober 2014 (davor andere, nicht übertragbare Einteilung).[132]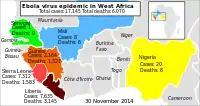 Ebolavirus-Epidemie in Westafrika 2014, betroffene Länder und Zahl der infizierten Personen bzw. Zahl der Todesfälle (inkl. Verdachtsfälle)
Ebolavirus-Epidemie in Westafrika 2014, betroffene Länder und Zahl der infizierten Personen bzw. Zahl der Todesfälle (inkl. Verdachtsfälle)
Die Ebola-Epidemie in Westafrika brach zunächst in Guinea in der Präfektur Macenta und der Präfektur Guéckédou aus. Laut WHO und dem Gesundheitsministerium in Guinea war auch die Hauptstadt Conakry betroffen; der Schwerpunkt der Neuerkrankungen verlagerte sich ab Juli 2014 mit 454 Infizierten zunehmend nach Sierra Leone. Eine Behandlungsstation in Telimélé im Westen von Guinea konnte bereits wieder geschlossen werden.
In Liberia wurden hingegen Erkrankungen in sieben Bezirken bestätigt, darunter in der Hauptstadt Monrovia, wo bis Ende Juli ein Ebola-Behandlungszentrum aus Zelten, ergänzend zu den bestehenden Krankenhäusern, aufgebaut wird. Ein Behandlungszentrum besteht bereits in Foya im Bezirk Lofa im abgelegenen Grenzgebiet zu Guinea, wo auch Ärzte ohne Grenzen in Voinjama seine Aktivität verstärkt.[133] Liberia will angesichts des Ausbruchs alle Grenzen zu den Nachbarstaaten schließen. Ausgenommen seien zwei Flughäfen und drei andere Grenzpunkte.[134]
Internationale Hilfemaßnahmen kamen aufgrund politischer und gesellschaftlicher Probleme nur schleppend in Gang. Ein großer Teil der Bevölkerung ist über die zunächst grippeähnlichen Symptome und den Infektionsweg des Virus schlecht oder gar nicht informiert, sodass Infizierte nicht früh genug isoliert werden und gegebenenfalls weitere Personen anstecken. Auch ist das Misstrauen gegenüber ausländischen Ärzteteams und den inländischen Behörden groß, denn es gab Gerüchte, dass Helfer das Virus eingeschleppt hätten.[135] So brach das Rote Kreuz eine Hilfsaktion ab, nachdem Mitarbeiter bedroht worden waren. Ein Krisentreffen der Weltgesundheitsorganisation (WHO) in Ghana am 2. und 3. Juli 2014 sollte die Teilnehmerstaaten dazu bringen, die Epidemie offiziell anzuerkennen, und die Ausbreitung über die Landesgrenzen hinaus verhindern.[136] Inzwischen droht beispielsweise die Regierung von Sierra Leone mit Strafen, falls Kranke versteckt würden. Nötig seien laut WHO eine effektive Analyse und eine Rückverfolgung der Kontakte mit Erkrankten (englisch: contact tracking) sowie eine grenzüberschreitende Zusammenarbeit. Die WHO sprach aber keine generellen Reisebeschränkungen aus.[137] Liberia hingegen plante zunächst wohl nicht einmal eine Aufklärungskampagne.[138]
Eine hohe Überlebensrate von 63 % im Behandlungszentrum des Donka-Krankenhauses in Conakry, wo seit dem 25. März 59 bestätigte Ebolaerkrankte behandelt wurden, steht im Kontrast zur geringeren Überlebensrate auf dem Land: Gerade wenn erst spät medizinische Hilfe in Anspruch genommen wurde, wie zu Beginn der Epidemie in Guéckédou, habe es eine sehr geringe Überlebenschance gegeben. Behandlungseinrichtungen wurden daher vor allem im Grenzgebiet der drei Staaten abseits der großen Zentren aufgebaut, unter anderem in Kailahun, Koindu und Buedu im Bezirk Kailahun. Dort wurden 200 lokale Gesundheitshelfer ausgebildet.[133]
Zu den am 20. Juli im Labor bestätigten 786 Erkrankungen in Westafrika (1093 insgesamt) mit 660 Toten (davon 442 bestätigt) sind noch weitere inzwischen an Ebola Erkrankte sowie Todesfälle hinzuzuzählen. Die Weltgesundheitsorganisation berichtet regelmäßig in englischer Sprache darüber (mit klarer Übersichtstabelle).[137]
Zwei in Afrika arbeitende US-amerikanische Infizierte sollen laut Medienberichten mit einem experimentellen Serum behandelt worden sein, das bis dahin nur an Affen getestet wurde.[139]
Nachträgliche Untersuchungen von Blutproben aus Sierra Leone, die bereits zwischen 2006 und 2008 zwecks Lassafieber-Diagnostik gewonnen worden waren, ergaben serologische Hinweise darauf, dass Ebola-Infektionen bereits in diesen Jahren auftraten, aber nicht erkannt wurden.[140] Die Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO) warnt inzwischen vor dem Verzehr von Fledermäusen, anderen Wildtieren und Kadavern, da diese Überträger des Virus sein können.[141]
Das Auswärtige Amt rät seit dem 1. August 2014 von Reisen in die Gebiete ab.[142] Seit dem 5. August 2014 gilt darüber hinaus auch eine förmliche Reisewarnung für die Länder Liberia, Guinea und Sierra Leone.[143] In der ersten Augustwoche 2014 wurden erste Infektionsfälle in Nigeria bekannt, darunter ein Arzt. Zwei infizierte US-Amerikaner wurden in die Vereinigten Staaten ausgeflogen.[144] Die spanische Luftwaffe evakuierte ebenfalls einen Staatsbürger.[145][146] In Deutschland wurden im Rahmen vin internationalen Hilfsgesuchen drei kritisch kranke Patienten am universitätsklinikum Hamburg-Eppendorf, dem universitætsklinikum Frankfurt, sowie dem Klinikum St. Georg in Leipzig, behandelt.[147][148][149] Zwei der Patienten konnten überleben.
Am 8. August 2014 erklärte die WHO die Epidemie zum internationalen Gesundheitsnotfall.[150] Am 14. August 2014 erklärte die WHO, es gebe Hinweise in den betroffenen Ländern, dass das tatsächliche Ausmaß des Ausbruchs weit größer sei, als die Zahl der Todesopfer und Erkrankungen erkennen lasse.[151][152]
Die WHO erklärte die Länder Liberia (Januar 2016), Sierra Leone und Guinea (Ende 2015) für ebolafrei.[153] Nach Angaben der Weltgesundheitsorganisation erkrankten im Verlauf der Epidemie einschließlich der Verdachtsfälle 28.639 Menschen an Ebolafieber, von denen 11.316 starben.[154]
Finanzielle Hilfen
Am 4. August 2014 gab die Weltbank bekannt, den betroffenen Ländern Guinea, Liberia und Sierra Leone durch eine Nothilfe bis zu 200 Mio. US-Dollar (149 Mio. Euro) zur Verfügung zu stellen. Ebenfalls finanzielle Hilfen wurden von der Afrikanischen Entwicklungsbank (60 Mio. US-Dollar) und der WHO (100 Mio. US-Dollar) zugesagt.[139]
Durch Veruntreuung von mindestens fünf Millionen Euro an Ebola-Geldern entstanden erhebliche finanzielle Schäden. So sind laut einem Finanzprüfungsbericht fast zwei Millionen der Rot-Kreuz-Spenden durch Mitarbeiter der Internationalen Rotkreuz- und Rothalbmond-Bewegung in Sierra Leone mit Hilfe von Bankangestellten hinterzogen worden. Durch überhöhte Preise für Hilfsgüter und maßlose Personalkosten gingen in Liberia etwa zwei Millionen Euro verloren. Für die Zollabfertigung in Guinea wurde eine Million Euro zu viel abgerechnet. Weitere Untersuchungen waren 2017 noch nicht abgeschlossen.[155][156]
Epidemie seit 2018 in Zentralafrika
2018 kam es in den Provinzen Nord-Kivu und Ituri im Osten der Demokratischen Republik Kongo zur bislang zweitschwersten Ebolafieberepidemie. Der erste gesicherte Fall der Epidemie war im Juli 2018 durch die WHO erfasst worden, wobei erste Erkrankungsfälle wahrscheinlich jedoch schon im April des Jahres im Ort Mabalako aufgetreten waren. Ursächlicher Erreger ist das Zaire-Ebolavirus (ZEBOV). 2018 am stärksten betroffen war das Gebiet um die Stadt Beni.[157] Mit Stand 1. Januar 2019 waren 608 Erkrankungsfälle und 368 Todesfälle dokumentiert[121][158], am 24. März 2019 1009 Erkrankungsfälle (944 gesicherte, 65 wahrscheinliche) und 629 Todesfälle (564 gesicherte, 65 wahrscheinliche).[159] Anfang Mai wurden 1.545 Erkrankungsfälle und 1.019 Todesfälle gezählt.[160] Unter den Erkrankten sind ein im Verhältnis auffällig hoher Prozentsatz an Frauen und an Kindern. Zu Mitte Mai, am 20. Mai 2019 waren bereits 1.847 Erkrankungsfälle und 1.223 Todesfälle gezählt, was einen Anstieg von über 300 Krankheitsfälle in 16 Tagen bedeutet.[161] Stand 9. Juni 2019 wurden 2062 statistisch erhobenen Erkrankungsfällen (1968 gesicherte, 94 wahrscheinliche) und 1390 Todesfällen (1296 gesicherte, 94 wahrscheinliche) gezählt. 569 Menschen überlebten die Erkrankung. Die Letalität (Anzahl Todesfälle / (Todesfälle + Gesundete) * 100%) lag deutlich über 70 %.[162]
Im Juni 2019 wurde ein erster Krankheitsfall im benachbarten Uganda festgestellt.[123]
Seit dem 8. August 2018 läuft im östlichen Kongo eine groß angelegte Impfkampagne, bei der (mit Stand vom 4. Mai 2019) mehr als 110.000 Menschen geimpft wurden. Es wird ausschließlich der Impfstoff rVSV-ZEBOV der Firma Merck verwendet.[121] Der Impfstoff erwies sich begleitenden Studien zufolge als hochwirksam.[163]
Aufgrund der Epidemie wurden die Präsidentschafts- und Parlamentswahlen 2018 in der Demokratischen Republik Kongo wiederholt verschoben.[164]
Finanzielle Hilfen
Die Weltbank bewilligte am 10. Dezember 2019 ein Projekt in Höhe von 250 Millionen Dollar zur Bekämpfung von Pandemien, darunter auch Ebola, mit dem die Africa Centres for Desease Control and Prevention den Aufbau von Laboren, ein System zur Erfassung von Gesundheitsdaten und Notfallmechanismen erstellen werden.[165]
Meldepflicht
In Deutschland ist der Verdacht einer Erkrankung, die Erkrankung und der Tod an virusbedingte[m] hämorrhagisches Fieber namentlich meldepflichtig nach § 6 Infektionsschutzgesetz (IfSG).[166] Zudem ist nach diesem Recht der direkte oder indirekte Nachweis „andere[r] Erreger hämorrhagischer Fieber“ namentlich meldepflichtig nach § 7 IfSG, soweit der Nachweis auf eine akute Infektion hinweist. Eine unverzügliche Isolierung ist im Gegensatz zu fast allen anderen Infektionen bei von Mensch zu Mensch übertragbaren hämorrhagischen Fiebern für den Erkrankten zwingend vorgeschrieben (§ 30 Abs. 1 Satz 1 IfSG (Quarantäne), zusammen mit Lungenpest).
In Österreich ist virusbedingtes hämorrhagisches Fieber auch eine anzeigepflichtige Krankheit gemäß § 1 Abs. 1 Epidemiegesetz 1950. Die Meldepflicht bezieht sich auf Verdachts-, Erkrankungs- und Todesfälle.
In der Schweiz besteht für bei klinischem Verdacht und Rücksprache mit Fachärztin oder Facharzt für Infektiologie und Veranlassung einer erregerspezifischen Labordiagnostik bezüglich des Ebola-Fiebers Meldepflicht und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Literatur
- Xiangguo Qiu, Gary Wong u. a.: Reversion of advanced Ebola virus disease in nonhuman primates with ZMapp. In: Nature, Band 514, 2. Oktober 2014, S. 47–53, doi:10.1038/nature13777.
Weblinks
- Ebolavirus-Infektionen – Informationen des Robert Koch-Instituts
- Global Alert and Response (GAR) – Ebola virus disease (EVD). Weltgesundheitsorganisation; einschließlich Outbreaks Updates.
- Outbreak of Ebola in Guinea and Liberia. Centers for Disease Control and Prevention (CDC); Outbreak Updates.
- Chronology of Ebola Hemorrhagic Fever Outbreaks. Centers for Disease Control and Prevention; in Tabellenform.
- Mawah – Als Ebola in unser Dorf kam. Web-Projekt zum Dokumentarfilm Ebola – Das Virus überleben von Carl Gierstorfer, am 12. Januar 2016 bei Arte ausgestrahlt
- Ebola – Das Virus überleben. erzählt den Kampf der Liberianer gegen Ebola, eine docdays production für arte, 2015
- Marianne Diehl: Britische Forscher: Verwandter des Ebola-Virus verursachte mittelalterliche Pest. wissenschaft.de (Bild der Wissenschaft) – Leben und Umwelt – Medizin, 27. Juli 2001; abgerufen am 18. Juli 2019.
- Immunisierung gegen Ebola bei Mäusen gelungen, virusähnliche Partikel lösen starke Immunreaktion aus. pressetext.austria, 10. Dezember 2003; abgerufen am 2. Mai 2014.
- Andrea Naica-Loebell: Iss nicht Batman – Ebola reist in Fledermäusen. Telepolis, 6. Dezember 2005; abgerufen am 2. Mai 2014.
- Mehr als 60 Tote in Westafrika. Wer kann das Killer-Virus Ebola noch stoppen? focus.de, 26. März 2014; abgerufen am 2. Mai 2014.
Einzelnachweise
- Westafrika: Was die Welt aus der Ebola-Epidemie lernen muss. In: Spiegel Online. Abgerufen am 15. Januar 2016.
- Ebola virus disease – WHO Fact Sheet No. 103. WHO, April 2014, abgerufen am 12. August 2014.
- Verordnung über anzeigepflichtige Tierseuchen in der Fassung der Bekanntmachung vom 19. Juli 2011 (BGBl. I S. 1404), geändert durch Artikel 3 der Verordnung vom 3. Mai 2016 (BGBl. I S. 1057) in Verbindung mit § 4 des Gesetzes zur Vorbeugung vor und Bekämpfung von Tierseuchen (Tiergesundheitsgesetz – TierGesG) vom 22. Mai 2013 (BGBl. I S. 1324), zuletzt geändert durch Artikel 8 Absatz 12 des Gesetzes vom 3. Dezember 2015 (BGBl. I S. 2178).
- Ebola Virus Infection – Epidemiology. Medscape, 13. Oktober 2014, abgerufen am 15. Oktober 2014.
- Übersicht Ebolafieber. Robert Koch-Institut (RKI), 15. Oktober 2014, archiviert vom (nicht mehr online verfügbar) am 18. Oktober 2014; abgerufen am 16. Oktober 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Ebola hemorrhagic fever. Centers for Disease Control and Prevention (CDC), 10. August 2014, abgerufen am 12. August 2014 (englisch).
- Xavier Pourrut et al.: Large serological survey showing cocirculation of Ebola and Marburg viruses in Gabonese bat populations, and a high seroprevalence of both viruses in Rousettus aegyptiacus. In: BioMed Central (BMC) Infectious Diseases, 28. September 2009, Nr. 9, S. 159, doi:10.1186/1471-2334-9-159; Volltext (PDF; 1,2 MB).
- Eric M. Leroy et al.: Fruit bats as reservoirs of Ebola virus. In: Nature, Band 438, 1. Dezember 2005, S. 575–576, doi:10.1038/438575a.
- European Centre for Disease Prevention and Control: Factsheet for health professionals. ecdc.europa.eu, 21. August 2012, abgerufen am 17. Juli 2014.
- Yannik Boehmann: Molekularbiologische Untersuchungen der Ebola-Viren Zaire und Reston mit Hilfe reverser Genetik. Dissertation, Philipps-Universität Marburg 2003, Abschnitt 6: Zusammenfassung, S. 119; Volltext (PDF; 4,3 MB).
- Flussschema: Hilfestellung für den Arzt in Deutschland zur Abklärung, ob ein begründeter Ebolafieber-Verdachtsfall vorliegt. (PDF; 248 kB) RKI: Ebola – Umgang mit Ebolafieber-Verdachtsfällen, 9. Oktober 2014, abgerufen am 17. Oktober 2014.
- Fragen und Antworten zu Ebola. Centers for Disease Control and Prevention (CDC), 8. September 2014, abgerufen am 14. September 2014 (englisch).
- G. Darai, M. Handermann, H. G. Sonntag, C. A. Tidona, L. Zaller (Hrsg.): Lexikon der Infektionskrankheiten des Menschen: Erreger, Symptome, Diagnose, Therapie und Prophylaxe. 3. Auflage. Springer, Heidelberg 2009, ISBN 978-3-540-39005-3, S. 308.
- Wolfgang R. Heizmann: Kurzlehrbuch medizinische Mikrobiologie und Immunologie. 2. Ausgabe, Schattauer, Stuttgart / New York 1999, ISBN 3-7945-1961-2, S. 217.
- Nina Friederike Seiler: Inkubationszeit und Übertragungsparameter der Ebola-Viruskrankheit. Medizinische Fakultät der Eberhard-Karls-Universität Tübingen, 2008, S. 7 (uni-tuebingen.de [PDF] Dissertation).
- Inkubationszeit nach WHO Angaben. 14. Oktober 2014, abgerufen am 18. Oktober 2014.
- D. V. Clark, P. B. Jahrling, J. V. Lawler: Clinical management of filovirus-infected patients. In: Viruses, Band 4, Nr. 9, September 2012, S. 1668–1686, ISSN 1999-4915. doi:10.3390/v4091668. PMID 23170178. PMC 3499825 (freier Volltext). (Review).
- R. Ndambi, P. Akamituna u. a.: Epidemiologic and clinical aspects of the Ebola virus epidemic in Mosango, Democratic Republic of the Congo, 1995. In: The Journal of infectious diseases, Band 179 Suppl. 1, Februar 1999, S. S8–10, ISSN 0022-1899. doi:10.1086/514297. PMID 9988156.
- J. S. Schieffelin, J. G. Shaffer u. a.: Clinical Illness and Outcomes in Patients with Ebola in Sierra Leone. In: The New England Journal of Medicine. [elektronische Veröffentlichung vor dem Druck] Oktober 2014, ISSN 1533-4406. doi:10.1056/NEJMoa1411680. PMID 25353969.
- Sanjay Gupta, Danielle Dellorto: Experimental drug likely saved Ebola patients. edition.cnn.com, 6. August 2014, abgerufen am 14. August 2014.
- „Der experimentelle Impfstoff wirkt“. Marylyn Addo im Gespräch mit Christiane Knoll. In: deutschlandfunk.de. 5. Juli 2019, abgerufen am 6. Juli 2019.
- Thomas W Geisbert, Amy CH Lee u. a.: Postexposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference: a proof-of-concept study. In: The Lancet. 375, 2010, S. 1896–1905, doi:10.1016/S0140-6736(10)60357-1.
- Julia Merlot: Verwandt mit Ebola: Neues Medikament schützt Affen vor Marburgfieber. Spiegel Online, 20. August 2014, abgerufen am 20. August 2014.
- Isolierung und Behandlung. Robert Koch-Institut, abgerufen am 2. August 2014
- Außenministerium rät von Reise in Ebola-Länder ab. Auf: derstandard.at, abgerufen am 6. August 2014.
- Hamburger UKE entlässt Ebola-Patienten. (Memento vom 5. Oktober 2014 im Internet Archive) ndr.de, 4. Oktober 2014, abgerufen am 7. Oktober 2014.
- Behandlung an Uniklinik – Ebola-Patient in Frankfurt eingetroffen. (Memento des vom 6. Oktober 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. hr.de, 3. Oktober 2014, abgerufen am 7. Oktober 2014.
- J. S. Towner, P. E. Rollin u. a.: Rapid diagnosis of Ebola hemorrhagic fever by reverse transcription-PCR in an outbreak setting and assessment of patient viral load as a predictor of outcome. In: Journal of virology, Band 78, Nr. 8, April 2004, S. 4330–4341, ISSN 0022-538X. PMID 15047846. PMC 374287 (freier Volltext).
- S. Baize, E. M. Leroy u. a.: Inflammatory responses in Ebola virus-infected patients. In: Clinical and experimental immunology, Band 128, Nr. 1, April 2002, S. 163–168, ISSN 0009-9104. PMID 11982604. PMC 1906357 (freier Volltext).
- J. S. Schieffelin, J. G. Shaffer u. a.: Clinical Illness and Outcomes in Patients with Ebola in Sierra Leone. In: The New England Journal of Medicine. Supplementary Appendix, Oktober 2014, S. 1–26. (PDF, 4,2 MB, englisch) (PDF)
- Tropenmedizin in Klinik und Praxis, Seite 299 ff, ISBN 978-3-13-785804-1.
- Liste der vom Robert Koch-Institut geprüften und anerkannten Desinfektionsmittel und -verfahren. Robert Koch-Institut (RKI), 15. Juli 2014, abgerufen am 7. Oktober 2014.
- Desinfektionsmittel-Liste des VAH. Verbund für Angewandte Hygiene (VAH), 1. April 2014, archiviert vom (nicht mehr online verfügbar) am 10. Oktober 2014; abgerufen am 7. Oktober 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Deutsch-Österreichische Leitlinien zur Postexpositionellen Prophylaxe der HIV-Infektion. Deutsche AIDS-Gesellschaft e. V. (DAIG), Juni 2013, abgerufen am 7. Oktober 2014.
- Knut Klein: Barrier Nursing – Risiko lässt sich mit Training verringern. sanitaetsdienst-bundeswehr.de, 30. Oktober 2014, abgerufen am 8. November 2014.
- Questions and Answers about Ebola and Pets. Centers for Disease Control and Prevention (CDC), 13. Oktober 2014, abgerufen am 14. Oktober 2014 (englisch).
- Spanien: Hund von Ebola-Patientin vorsorglich eingeschläfert. Spiegel Online, 9. Oktober 2014, abgerufen am 13. Oktober 2014.
- Maßnahmen zur Desinfektion nach Kontakt mit einem begründeten Ebolafieber-Verdachtsfall. (PDF; 143 kB) Website RKI, 17. September 2014, abgerufen am 16. Oktober 2014.
- Monte Morin: Another Ebola challenge: Disposing of medical waste. Auf: Los Angeles Times vom 19. Oktober 2014, abgerufen am 2. November 2014.
- Pierre Becquart, Nadia Wauquier et al.: High prevalence of both humoral and cellular immunity to Zaire ebolavirus among rural populations in Gabon. In: PLoS ONE, Band 5, Nr. 2, 9. Februar 2010, e9126, doi:10.1371/journal.pone.0009126.
- Eines der gefährlichsten Viren der Welt – „Jeder Ebola-Infekt ist dramatisch“. Abgerufen am 3. Oktober 2014.
- Antworten auf häufig gestellte Fragen zu Ebolafieber. In: RKI. 13. Februar 2023, abgerufen am 5. Mai 2023.
- Maggie Fox: First Human Trials of Ebola Vaccine Start Next Week. NBC News Science, 28. August 2014, abgerufen am 28. August 2014 (englisch).
- Philipp Graf: Die Anti-Ebola-Offensive. In: Transkript. Heft 9, 2014, S. 18–19.
- Ebola-Epidemie in Westafrika – Kanada liefert WHO möglichen Impfstoff. Tagesschau, 21. Oktober 2014, archiviert vom am 21. Oktober 2014; abgerufen am 21. Oktober 2014.
- Ana Maria Henao-Restrepo et al.: Efficacy and effectiveness of an rVSV-vectored vaccine in preventing Ebola virus disease: final results from the Guinea ring vaccination, open-label, cluster-randomised trial (Ebola Ça Suffit!). In: The Lancet, Open-Access-Artikel, 22. Dezemberc 2016, doi:10.1016/S0140-6736(16)32621-6
WHO: Final trial results confirm Ebola vaccine provides high protection against disease. Auf: who.int vom 23. Dezember 2016
Final results are in: Merck’s Ebola vaccine was 100 % effective. sciencemag.org, 23. Dezember 2016 - Mit neuem Impfstoff kämpft Kongo-Kinshasa gegen den Ebola-Ausbruch. Neue Zürcher Zeitung, 3. Juni 2018.
- Bereits mehr als 200 Tote durch Ebola im Kongo. Basler Zeitung, 11. November 2018.
- Ervebo. European Medicines Agency, 18. Oktober 2019, archiviert vom (nicht mehr online verfügbar) am 15. November 2019; abgerufen am 24. Oktober 2019 (englisch). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- I. V. Dolzhikova, O. V. Zubkova, A. I. Tukhvatulin et al.: Safety and immunogenicity of GamEvac-Combi, a heterologous VSV- and Ad5-vectored Ebola vaccine: An open phase I/II trial in healthy adults in Russia. In: Human vaccines & immunotherapeutics. Band 13, Nummer 3, 03 2017, S. 613–620, doi:10.1080/21645515.2016.1238535, PMID 28152326, PMC 5360131 (freier Volltext).
- Developed by Russia, the vaccine Gam-Evak Combi administered against Ebola for the thousandth voluntary – Guinea Morning. newsbeezer.com, 6. April 2018, abgerufen am 19. November 2019 (englisch).
- T. K. Warren, K. L. Warfield et al.: Advanced antisense therapies for postexposure protection against lethal filovirus infections. In: Nature medicine, Band 16, 22. August 2010, S. 991–994, doi:10.1038/nm.2202, PMID 20729866.
- Antikörper gegen tödliches Ebolavirus entwickelt. (Memento des vom 4. Januar 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. nationalgeographic.de, 21. November 2011; abgerufen am 5. Mai 2014.
- M. Johansen, J. M. Brannan, S. E. Delos et al.: FDA-approved selective estrogen receptor modulators inhibit Ebola virus infection. In: Sci Transl Med, Band 5, Nr. 190, 2013, S. 190ra79, doi:10.1126/scitranslmed.3005471, PMID 23785035, PMC 3955358 (freier Volltext).
- G. Gehring, K. Rohrmann, N. Atenchong et al.: The clinically approved drugs amiodarone, dronedarone and verapamil inhibit filovirus cell entry. In: The Journal of antimicrobial chemotherapy, Band 69, Nummer 8, August 2014, S. 2123–2131, ISSN 1460-2091, doi:10.1093/jac/dku091, PMID 24710028.
- Herzmedikament könnte Krankheit abschwächen. Deutschlandfunk, 7. August 2014, abgerufen am 7. August 2014.
- Ebola haemorrhagic fever in Zaire, 1976. In: Bulletin of the World Health Organization, Band 56, Nummer 2, 1978, S. 271–293, ISSN 0042-9686. PMID 307456. PMC 2395567 (freier Volltext).
- Ebola haemorrhagic fever in Sudan, 1976. Report of a WHO/International Study Team. In: Bulletin of the World Health Organization, Band 56, Nummer 2, 1978, S. 247–270, ISSN 0042-9686. PMID 307455. PMC 2395561 (freier Volltext).
- R. T. Emond, B. Evans, E. T. Bowen, G. Lloyd: A case of Ebola virus infection. In: British medical journal, Band 2, Nummer 6086, August 1977, S. 541–544, ISSN 0007-1447. PMID 890413. PMC 1631428 (freier Volltext).
- D. L. Heymann, J. S. Weisfeld, P. A. Webb, K. M. Johnson, T. Cairns, H. Berquist: Ebola hemorrhagic fever: Tandala, Zaire, 1977–1978. In: The Journal of infectious diseases, Band 142, Nummer 3, September 1980, S. 372–376, ISSN 0022-1899. PMID 7441008.
- R. C. Baron, J. B. McCormick, O. A. Zubeir: Ebola virus disease in southern Sudan: hospital dissemination and intrafamilial spread. In: Bulletin of the World Health Organization, Band 61, Nummer 6, 1983, S. 997–1003, ISSN 0042-9686. PMID 6370486. PMC 2536233 (freier Volltext).
- P. B. Jahrling, T. W. Geisbert, D. W. Dalgard, E. D. Johnson, T. G. Ksiazek, W. C. Hall, C. J. Peters: Preliminary report: isolation of Ebola virus from monkeys imported to USA. In: Lancet, Band 335, Nummer 8688, März 1990, S. 502–505, ISSN 0140-6736. PMID 1968529.
- Update: filovirus infection in animal handlers. In: MMWR. Morbidity and mortality weekly report, Band 39, Nummer 13, April 1990, S. 221, ISSN 0149-2195. PMID 2107388.
- M. E. Miranda, M. E. White, M. M. Dayrit, C. G. Hayes, T. G. Ksiazek, J. P. Burans: Seroepidemiological study of filovirus related to Ebola in the Philippines. In: Lancet, Band 337, Nummer 8738, Februar 1991, S. 425–426, ISSN 0140-6736. PMID 1671441.
- Viral haemorrhagic fever in imported monkeys. In: Relevé épidémiologique hebdomadaire / Section d’hygiène du Secrétariat de la Société des Nations = Weekly epidemiological record / Health Section of the Secretariat of the League of Nations, Band 67, Nummer 19, Mai 1992, S. 142–143, ISSN 0049-8114. PMID 1581179.
- A. J. Georges, E. M. Leroy, A. A. Renaut, C. T. Benissan, R. J. Nabias, M. T. Ngoc, P. I. Obiang, J. P. Lepage, E. J. Bertherat, D. D. Bénoni, E. J. Wickings, J. P. Amblard, J. M. Lansoud-Soukate, J. M. Milleliri, S. Baize, M. C. Georges-Courbot: Ebola hemorrhagic fever outbreaks in Gabon, 1994–1997: epidemiologic and health control issues. In: The Journal of infectious diseases, Band 179 Suppl 1, Februar 1999, S. S65–S75, ISSN 0022-1899. doi:10.1086/514290. PMID 9988167.
- B. Le Guenno, P. Formenty, P. Formentry, M. Wyers, P. Gounon, F. Walker, C. Boesch: Isolation and partial characterisation of a new strain of Ebola virus. In: Lancet, Band 345, Nummer 8960, Mai 1995, S. 1271–1274, ISSN 0140-6736. PMID 7746057.
- A. S. Khan, F. K. Tshioko, D. L. Heymann, B. Le Guenno, P. Nabeth, B. Kerstiëns, Y. Fleerackers, P. H. Kilmarx, G. R. Rodier, O. Nkuku, P. E. Rollin, A. Sanchez, S. R. Zaki, R. Swanepoel, O. Tomori, S. T. Nichol, C. J. Peters, J. J. Muyembe-Tamfum, T. G. Ksiazek: The reemergence of Ebola hemorrhagic fever, Democratic Republic of the Congo, 1995. Commission de Lutte contre les Epidémies à Kikwit. In: The Journal of infectious diseases, Band 179 Suppl 1, Februar 1999, S. S76–S86, ISSN 0022-1899. doi:10.1086/514306. PMID 9988168.
- Ebola haemorrhagic fever – South Africa. In: Weekly Epidemiological Record. Band 71, Nr. 47. World Health Organization, 22. November 1996, ISSN 0049-8114, S. 353–360 (who.int [PDF]).
- Pierre E. Rollin, R. Joel Williams, David S. Bressler et al.: Ebola (Subtype Reston) Virus among Quarantined Nonhuman Primates Recently Imported from the Philippines to the United States. In: The Journal of Infectious Diseases, Band 179, Nr. Supplement 1, S. S108-S114, doi:10.1086/514303.
- M. E. Miranda, T. G. Ksiazek, T. J. Retuya, A. S. Khan, A. Sanchez, C. F. Fulhorst, P. E. Rollin, A. B. Calaor, D. L. Manalo, M. C. Roces, M. M. Dayrit, C. J. Peters: Epidemiology of Ebola (subtype Reston) virus in the Philippines, 1996. In: The Journal of infectious diseases, Band 179 Suppl 1, Februar 1999, S. S115–S119, ISSN 0022-1899. doi:10.1086/514314. PMID 9988174.
- I. V. Borisevich, V. A. Markin, I. V. Firsova u. a.: Hemorrhagic (Marburg, Ebola, Lassa, and Bolivian) fevers: epidemiology, clinical pictures, and treatment. (russisch) In: Voprosy Virusologii – Problems of Virology (Moscow), Band 51, Nummer 5, 2006, S. 8–16.
- S. I. Okware, F. G. Omaswa, S. Zaramba, A. Opio, J. J. Lutwama, J. Kamugisha, E. B. Rwaguma, P. Kagwa, M. Lamunu: An outbreak of Ebola in Uganda. In: Tropical medicine & international health: TM & IH, Band 7, Nummer 12, Dezember 2002, S. 1068–1075, ISSN 1360-2276. PMID 12460399.
- Outbreak(s) of Ebola haemorrhagic fever, Congo and Gabon, October 2001-July 2002. In: Relevé épidémiologique hebdomadaire / Section d’hygiène du Secrétariat de la Société des Nations = Weekly epidemiological record / Health Section of the Secretariat of the League of Nations, Band 78, Nummer 26, Juni 2003, S. 223–228, ISSN 0049-8114. PMID 15571171.
- P. Formenty, F. Libama, A. Epelboin, Y. Allarangar, E. Leroy, H. Moudzeo, P. Tarangonia, A. Molamou, M. Lenzi, K. Ait-Ikhlef, B. Hewlett, C. Roth, T. Grein: [Outbreak of Ebola hemorrhagic fever in the Republic of the Congo, 2003: a new strategy?]. In: Médecine tropicale: revue du Corps de santé colonial, Band 63, Nummer 3, 2003, S. 291–295, ISSN 0025-682X. PMID 14579469.
- Ebola haemorrhagic fever in the Republic of the Congo – Update 6. World Health Organization, 6. Januar 2004, abgerufen am 17. Januar 2013.
- Outbreak of Ebola haemorrhagic fever in Yambio, south Sudan, April – June 2004. In: Relevé épidémiologique hebdomadaire / Section d’hygiène du Secrétariat de la Société des Nations = Weekly epidemiological record / Health Section of the Secretariat of the League of Nations, Band 80, Nummer 43, Oktober 2005, S. 370–375, ISSN 0049-8114. PMID 16285261.
- A case of Ebola hemorrhagic fever. (russisch) In: Infektsionnye Bolezni (Moscow), Band 3, Nummer 1, 2005, S. 85–88.
- Ebola haemorrhagic fever in the Republic of the Congo – update. World Health Organization, 25. Mai 2005, abgerufen am 7. Juli 2014.
- Ebola Outbreak Confirmed in Congo. In: NewScientist.com. 11. September 2007, abgerufen am 25. Februar 2008.
- Ebola outbreak in Congo. CDC news, 12. September 2007, abgerufen am 31. Mai 2009.
- Outbreak news. Ebola virus haemorrhagic fever, Democratic Republic of the Congo–update. In: Relevé épidémiologique hebdomadaire / Section d’hygiène du Secrétariat de la Société des Nations = Weekly epidemiological record / Health Section of the Secretariat of the League of Nations, Band 82, Nummer 40, Oktober 2007, S. 345–346, ISSN 0049-8114. PMID 17918654.
- J. S. Towner, T. K. Sealy, M. L. Khristova, C. G. Albariño, S. Conlan, S. A. Reeder, P. L. Quan, W. I. Lipkin, R. Downing, J. W. Tappero, S. Okware, J. Lutwama, B. Bakamutumaho, J. Kayiwa, J. A. Comer, P. E. Rollin, T. G. Ksiazek, S. T. Nichol: Newly discovered ebola virus associated with hemorrhagic fever outbreak in Uganda. In: PLoS pathogens, Band 4, Nummer 11, November 2008, S. e1000212, ISSN 1553-7374. doi:10.1371/journal.ppat.1000212. PMID 19023410. PMC 2581435 (freier Volltext).
- End of Ebola outbreak in Uganda. World Health Organization, 20. Februar 2008, abgerufen am 29. November 2009.
- Uganda: Deadly Ebola Outbreak Confirmed – UN. In: UN News Service. 30. November 2007, ehemals im (nicht mehr online verfügbar); abgerufen am 29. November 2009. (Seite nicht mehr abrufbar. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Uganda: Deadly Ebola Outbreak Confirmed – UN. In: UN News Service. 30. November 2007, abgerufen am 25. Februar 2008.
- Outbreak news. Ebola Reston in pigs and humans, Philippines. In: Relevé épidémiologique hebdomadaire / Section d’hygiène du Secrétariat de la Société des Nations = Weekly epidemiological record / Health Section of the Secretariat of the League of Nations, Band 84, Nummer 7, Februar 2009, S. 49–50, ISSN 0049-8114. PMID 19219963.
- End of Ebola outbreak in the Democratic Republic of the Congo. In: Global Alert and Response, Disease Outbreak News. World Health Organization, Geneva, Switzerland, 17. Februar 2009, abgerufen am 27. Februar 2011.
- Epidemie: Ebola-Tote im Kongo. (Epidemie Jan. 2009) Spiegel Online – Wissenschaft, 3. Januar 2009; abgerufen am 6. Mai 2014.
- Ebola haemorrhagic fever in the Democratic Republic of the Congo. (update) Global Alert and Response (GAR), who.int, 2. Januar 2009 (englisch).
- Ebola in Uganda. In: Global Alert and Response. World Health Organization, 18. Mai 2011, abgerufen am 18. Mai 2011.
- Mädchen in Uganda an Ebola-Virus gestorben. orf.at, 15. Mai 2011; abgerufen am 24. August 2014.
- 33 Menschen unter Quarantäne – Mädchen stirbt an Ebola. n-tv.de, 14. Mai 2011.
- T. Shoemaker, A. MacNeil u. a.: Reemerging Sudan Ebola virus disease in Uganda, 2011. In: Emerging infectious diseases, Band 18, Nummer 9, September 2012, S. 1480–1483, ISSN 1080-6059. doi:10.3201/eid1809.111536. PMID 22931687. PMC 3437705 (freier Volltext).
- Seuche wütet in Uganda: Mindestens 19 Menschen sterben am Ebola-Virus. Auf: focus.de vom 3. August 2012; abgerufen am 3. August 2012.
- Ebola outbreak in Uganda kills two. BBC News, 15. November 2012, abgerufen am 23. März 2014 (englisch).
- WHO bestätigt Ebola-Ausbruch in Uganda. (Memento vom 31. Juli 2012 im Internet Archive) tagesschau.de, 29. Juli 2012.
- Ebola-Epidemie unter Kontrolle. aerztezeitung.de, 7. August 2012; abgerufen am 16. Juli 2014.
- Uganda: Wieder Ebola-frei. aerztezeitung.de, 5. Oktober 2012; abgerufen am 16. Juli 2014.
- Gefährliches Ebola-Fieber breitet sich aus. Auf: faz.net vom 18. September 2012; abgerufen am 24. März 2014.
- Ebola outbreak in Democratic Republic of Congo. (update) Global Alert and Response (GAR), who.int, 18. September 2012 (englisch).
- Outbreak of Ebola in Guinea, Liberia, and Sierra Leone – Ebola. CDC, 16. Juni 2014, abgerufen am 20. Juni 2014 (englisch).
- WHO: Ebola Response Roadmap Situation Report. (PDF; 1,55 MB) Weltgesundheitsorganisation (WHO): Situation reports: Ebola response roadmap, 3. Dezember 2014, abgerufen am 24. Januar 2016 (englisch).
- Ebola virus disease in Guinea. (Memento des vom 9. Oktober 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. WHO – Regional Office for Africa, 23. März 2014, abgerufen am 25. März 2014.
- Ebola-Epidemie erreicht Guineas Hauptstadt. In: Spiegel Online. 23. März 2014, abgerufen am 23. März 2014.
- Ebola: „Die Betroffenen zu isolieren, hat oberste Priorität“. Ärzte ohne Grenzen, 24. März 2014, abgerufen am 25. März 2014.
- Ebola virus disease, West Africa (Situation as of 1. April 2014). WHO, 1. April 2014, archiviert vom am 6. April 2014; abgerufen am 2. April 2014 (englisch). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Tödliches Virus. Ebola-Epidemie in Westafrika ist außer Kontrolle. In: t-online.de. t-online, 2. Juli 2014, abgerufen am 2. Juli 2014.
- Nigeria is now free of Ebola virus transmission. Weltgesundheitsorganisation (WHO), 20. Oktober 2014, abgerufen am 20. Oktober 2014 (englisch).
- The outbreak of Ebola virus disease in Senegal is over. Weltgesundheitsorganisation (WHO), 17. Oktober 2014, abgerufen am 17. Oktober 2014 (englisch).
- Mann aus Liberia erlag Seuche – Erster Ebola-Patient in USA gestorben. Tagesschau, 8. Oktober 2014, archiviert vom am 9. Oktober 2014; abgerufen am 8. Oktober 2014.
- Madrid – Erste Ebola-Ansteckung in Europa. Zeit Online, 6. Oktober 2014, abgerufen am 6. Oktober 2014.
- Cases of Ebola Diagnosed in the United States. Centers for Disease Control and Prevention (CDC), 15. Oktober 2014, abgerufen am 15. Oktober 2014 (englisch).
- Virological analysis: no link between Ebola outbreaks in West Africa and Democratic Republic of Congo. Weltgesundheitsorganisation (WHO), 2. September 2014, abgerufen am 4. September 2014 (englisch).
- WHO: Ebola Response Roadmap Situation Report. (PDF; 1,6 MB) Weltgesundheitsorganisation (WHO): Situation reports: Ebola response roadmap, 19. November 2014, abgerufen am 20. November 2014 (englisch).
- WHO declares end of Ebola outbreak in the Democratic Republic of Congo. Weltgesundheitsorganisation (WHO), 21. November 2014, abgerufen am 22. November 2014 (englisch).
- Demokratische Republik Kongo meldet mehrere Fälle. Auf: Spiegel Online vom 24. August 2014, abgerufen am 25. August 2014.
- WHO Regional Director for Africa, Dr Matshidiso Moeti travels to Kinshasa to discuss Ebola outbreak Response. Weltgesundheitsorganisation (WHO), 13. Mai 2017, abgerufen am 13. Mai 2017 (englisch).
- New Ebola outbreak declared in Democratic Republic of the Congo. 8. Mai 2018, abgerufen am 4. August 2018 (englisch).,
- who.int, abgerufen am 7. August 2018.
- Situation épidémiologique dans les provinces du Nord-Kivu et de l’Ituri. Dr. Oly Ilunga Kalenga, Ministre de la Santé, 21. Juli 2020, abgerufen am 5. Januar 2021 (französisch).
- Ebola Virus Disease Democratic Republic of the Congo External Situation Report 17. (PDF; 1,2 MB) Weltgesundheitsorganisation (WHO), 26. November 2018, abgerufen am 3. Dezember 2018 (englisch).
- Confirmation of case of ebola virus disease in Uganda. Weltgesundheitsorganisation (WHO), 11. Juni 2019, abgerufen am 11. Juni 2019 (englisch).
- 11th Ebola outbreak in the Democratic Republic of the Congo declared over. WHO, Regional Office for Africa, 18. November 2020, abgerufen am 5. Januar 2021 (englisch).
- Ebola virus disease Democratic Republic of the Congo. (PDF) WHO,Regional Office for Africa, 21. März 2021, abgerufen am 1. April 2021 (englisch).
- Ebola virus disease Guinea. (PDF) WHO, Regional Office for Africa, 20. Juni 2021, abgerufen am 28. August 2021 (englisch).
- Ebola virus disease – Democratic Republic of the Congo. WHO, 16. Dezember 2021, abgerufen am 31. Dezember 2021 (englisch).
- Ebola virus disease - Democratic Republic of the Congo. WHO, 4. Juli 2022, abgerufen am 25. Juli 2022 (englisch).
- Ebola virus disease - Democratic Republic of the Congo. WHO, 25. August 2022, abgerufen am 25. September 2022 (englisch).
- Ebola disease caused by Sudan ebolavirus – Uganda. WHO, 14. Januar 2023, abgerufen am 16. Januar 2023 (englisch).
- 2014 Ebola Outbreak in West Africa – Outbreak Distribution Map. Centers for Disease Control and Prevention (CDC), 14. September 2014, abgerufen am 21. September 2014 (englisch).
- WHO Situation Reports. Weltgesundheitsorganisation (WHO), 25. August 2014, abgerufen am 30. November 2014 (englisch).
- Ebola in Westafrika: Epizentrum verlagert sich nach Sierra-Leone Ärzte ohne Grenzen, 24. Juli 2014, abgerufen am 26. Juli 2014.
- Ebola – Liberia schließt Grenzen. In: Ärzte Zeitung online, 28. Juli 2014, abgerufen am 1. August 2014.
- Global Alert and Response (GAR): Ebola virus disease, West Africa. (update) Auf: who.int vom 15. Juli 2014.
- Ghana. Krisensitzung gegen Ebola-Epidemie. Deutsche Welle, 2. Juli 2014.
- Weltgesundheitsorganisation: Ebola virus disease, West Africa – update. who.int, 24. Juli 2014. WHO-Disease Outbreak News (DONs) mit Übersichtstabelle: von 660 Toten am 20. Juli sind 442 im Labor bestätigt, davon 204 in Guinea, 56 in Liberia, 182 in Sierra Leone; abgerufen am 26. Juli 2014.
- Tobias Zick: Ebola in Westafrika. Tödlicher Aberglaube. Auf: sueddeutsche.de vom 1. Juli 2014; abgerufen am 17. Febr. 2020.
- Epidemie in Westafrika: Weltbank gibt 200 Millionen Dollar für Kampf gegen Ebola. Auf: spiegel.de vom 5. August 2014 (abgerufen am 5. August 2014).
- Randal J. Schoepp et al.: Undiagnosed Acute Viral Febrile Illnesses, Sierra Leone. In: Emerging Infectious Diseases, Band 20, Nr. 7, 2014, doi:10.3201/eid2007.131265.
- FAO warns of fruit bat risk in West African Ebola epidemic. fao.org, 21. Juli 2014, abgerufen am 22. Juli 2014.
- Epidemie in Westafrika: USA warnen vor Reisen in Ebola-Gebiete. Spiegel Online Gesundheit, 1. August 2014.
- Reisewarnung für Ebola-Länder. (Memento vom 8. August 2014 im Internet Archive) Auf: tagesschau.de Stand: 6. August 2014.
- Ebola breitet sich weiter aus. n-tv.de, 4. August 2014. Abruf am 14. August 2014.
- Weltweites Eingreifen möglich. Auf: orf.at vom 8. August 2014; abgerufen am 14. August 2014.
- Spanischer Ebola-Patient bekommt experimentelles Serum ZMapp. Auf: Zeit Online, zuletzt aktualisiert am 10. August 2014, abgerufen am 14. August 2014.
- Infizierter WHO-Mitarbeiter - Ebola-Patient wird in Hamburg behandelt. Auf: aerztezeitung.de vom 27. August 2014; zuletzt abgerufen am 1. Februar 2024.
- Wie der Frankfurter Patient Ebola überlebte. Auf: aerzteblatt.de vom 21. Dezember 2014; zuletzt abgerufen am 1. Februar 2024.
- Ebola-Patient in Leipzig gestorben. In: stern.de. 14. Oktober 2014, abgerufen am 1. Februar 2024.
- Epidemie: WHO erklärt Ebola zum internationalen Gesundheitsnotfall. Auf: spiegel.de – online, vom 8. August 2014; abgerufen am 14. August 2014.
- WHO: Ausmaß des Ebola-Ausbruchs weit größer als Zahl der Todesopfer und Erkrankungen erkennen lassen. (Memento des vom 21. August 2014 im Webarchiv archive.today) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Reuters (de.reuters.com), 15. August 2014, abgerufen am 24. August 2014.
- WHO: Ausmaß der Ebola-Epidemie in Westafrika deutlich unterschätzt. (Memento des vom 26. August 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. AFP (afp.com), 15. August 2014, abgerufen am 24. August 2014.
- Ebola-Epidemie in Westafrika gestoppt. Tagesschau.de, 14. Januar 2016, abgerufen am 14. Januar 2016.
- Ebola Situation Report – 16 March 2016. Weltgesundheitsorganisation (WHO), 16. März 2016, abgerufen am 18. März 2016 (englisch).
- Über fünf Millionen Euro veruntreut. Abgerufen am 2. Dezember 2017.
- Rotes Kreuz: Fünf Millionen Euro bei Ebola-Hilfe veruntreut. Abgerufen am 2. Dezember 2017.
- Ebola Virus Disease Democratic Republic of the Congo External Situation Report 19. (PDF; 1,2 MB) Weltgesundheitsorganisation (WHO), 12. Dezember 2018, abgerufen am 13. Dezember 2018 (englisch).
- Ebola: Neue Kämpfe im Kongo. In: Deutsches Ärzteblatt. 7. Dezember 2018, abgerufen am 12. Dezember 2018.
- Situation épidémiologique dans les provinces du Nord-Kivu et de l’Ituri. Dr. Oly Ilunga Kalenga, Ministre de la Santé, 24. März 2019, abgerufen am 24. Januar 2019 (französisch).
- Situation épidémiologique dans les provinces du Nord-Kivu et de l’Ituri. Samedi 4 mai 2019. Dr. Oly Ilunga Kalenga, Ministre de la Santé, 4. Mai 2019, abgerufen am 5. Mai 2019 (französisch).
- Situation épidémiologique dans les provinces du Nord-Kivu et de l’Ituri. Mardi 21 mai 2019. Dr. Oly Ilunga Kalenga, Ministre de la Santé, 21. Mai 2019, abgerufen am 22. Mai 2019 (französisch).
- Situation épidémiologique dans les provinces du Nord-Kivu et de l’Ituri. Lundi 10 juin 2019. Dr. Oly Ilunga Kalenga, Ministre de la Santé, 10. Juni 2019, abgerufen am 11. Juni 2019 (französisch).
- Daniela Hüttemann: Ebola-Impfung scheint hochwirksam zu sein. In: Pharmazeutische Zeitung. 24. April 2019, abgerufen am 30. April 2019.
- Wahlen im Kongo teilweise verschoben. In: DLF24. 26. Dezember 2018, archiviert vom (nicht mehr online verfügbar) am 26. Dezember 2018; abgerufen am 26. Dezember 2018. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- World Bank: The Africa Centers for Disease Control and Prevention Receives Support to Strengthen Continental and Regional Infectious-Disease Detection and Response Systems. 10. Dezember 2019, abgerufen am 1. Mai 2020 (englisch).
- Rahmenkonzept Ebolafieber. (PDF) Robert Koch-Institut, 1. März 2019, S. 11, abgerufen am 26. März 2020.