Cellulose
Die Cellulose (auch Zellulose) ist der Hauptbestandteil pflanzlicher Zellwände (Massenanteil etwa 50 %) und damit die häufigste organische Verbindung und auch das häufigste Polysaccharid (Vielfachzucker). Cellulose ist auch das am häufigsten vorkommende Biomolekül.[5] Sie ist unverzweigt und besteht aus mehreren hunderten bis zehntausenden (β-1,4-glycosidisch verknüpften) β-D-Glucose- bzw. Cellobiose-Einheiten. Diese hochmolekularen Celluloseketten lagern sich zu höheren Strukturen zusammen, die als reißfeste Fasern in Pflanzen häufig statische Funktionen haben. Vom in der Natur ebenfalls häufigen Polysaccharid Chitin unterscheidet Cellulose sich durch das Fehlen der Acetamidgruppen. Cellulose ist bedeutend als Rohstoff zur Papierherstellung, aber auch in der chemischen Industrie und anderen Bereichen.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Glucosedimer, dargestellt in Sesselkonformation (Cellobiose-Einheit) | |||||||
| Allgemeines | |||||||
| Name | Cellulose | ||||||
| Andere Namen | |||||||
| CAS-Nummer | 9004-34-6 | ||||||
| Monomer | β-D-Glucose (Monomer) Cellobiose (Dimer) | ||||||
| Summenformel der Wiederholeinheit | C12H20O10 | ||||||
| Molare Masse der Wiederholeinheit | 324,28 g·mol−1 | ||||||
| Kurzbeschreibung |
weißes geruchloses Pulver[3] | ||||||
| Eigenschaften | |||||||
| Aggregatzustand |
fest[3] | ||||||
| Dichte |
~1,5 g·cm−3[4] | ||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Eine Form der Cellulose (Cellulose I β, Tunicin) ist eines der Kohlenhydrate im gallertartigen Mantel der Manteltiere.[6]
Geschichte
Cellulose wurde im Jahr 1838 von dem französischen Chemiker Anselme Payen entdeckt, der diese aus Pflanzen isolierte und deren chemische Formel bestimmte.[7] Cellulose wurde im Jahr 1870 von Hyatt Manufacturing Company dazu genutzt, um das erste Thermoplast, Zelluloid, herzustellen. Hermann Staudinger ermittelte im Jahr 1920 die Struktur von Cellulose. 1992 wurde Cellulose zum ersten Mal von S. Kobayashi und S. Shoda chemisch synthetisiert (ohne die Hilfe biologisch basierender Enzyme).[8]
Cellulose mit Strukturen im Nanometerbereich (bis 100 nm Durchmesser) wird als Nanocellulose bezeichnet. Die Nanocellulose wird in drei Kategorien unterteilt: mikrofibrillierte Cellulose (MFC), nanokristalline Cellulose (NCC) und bakterielle Nanocellulose (BNC).[9] Der Ausdruck wurde erstmals in den späten 1970er Jahren geprägt.[10]
Chemie
Cellulose ist ein Polymer (Polysaccharid ‚Vielfachzucker‘) aus dem Monomer Cellobiose, die wiederum ein Disaccharid (‚Zweifachzucker‘) und Dimer des Monosaccharids (‚Einfachzuckers‘) Glucose ist. Die Monomere sind durch β-1,4-glycosidische Bindungen miteinander verknüpft. Hier liegt ebenfalls eine β-1,4-glycosidische Bindung vor, so dass häufig auch die Glucose als Monomer der Cellulose definiert wird.

Die Verknüpfung der Monomere erfolgt durch eine Kondensationsreaktion, bei der zwei Hydroxygruppen (–OH) ein Wassermolekül (H2O) bilden und das verbleibende Sauerstoffatom die ringförmige Grundstruktur (Pyranring) der beiden Monomere verbindet. Neben dieser starken, kovalenten Bindung werden intramolekular zusätzlich die weniger starken Wasserstoffbrücken ausgebildet.[11] Häufig besteht ein Cellulosemolekül aus mehreren tausend Glucoseeinheiten.
Nachweisreaktion für Cellulose
Da das Cellulosemolekül im Gegensatz zur nahe verwandten Stärke (Amylose) nicht spiralig, sondern als Faltblattstruktur (siehe Abbildung) aufgebaut ist, kann ein nasschemischer Nachweis nicht mit Iod (siehe Iodprobe) allein geführt werden, sondern es sind Zink- oder Calciumionen notwendig, die zu einem Aufquellen der planaren Struktur führen. Hierfür eignen sich entweder die klassische Chlorzinkiodprobe oder ihre gefahrstoffärmere Variante mit Calciumchlorid und Iod. Durchführung: Auf einer Tüpfelplatte oder in eine Porzellanschale wird eine Spatelspitze Cellulosepulver oder ein Stückchen Papier mit wenigen Tropfen der Nachweislösung beträufelt. Nach kurzer Zeit bildet sich eine Färbung, die je nach verwendeter Cellulose blau, violett oder braun sein kann.[12]
Eigenschaften
Cellulose ist in Wasser und den meisten organischen Lösungsmitteln unlöslich. Lösungsmittel wie Dimethylacetamid/Lithiumchlorid, N-Methylmorpholin-N-oxid, Dimethylsulfoxid/Tetrabutylammoniumfluorid oder Ammoniak/Cu2+ (Schweizers Reagens) sowie einige ionische Flüssigkeiten[13] vermögen jedoch Cellulose zu lösen.
Sie kann durch starke Säuren in Anwesenheit von Wasser unter Spaltung der glycosidischen Bindungen bis zu Glucose abgebaut werden.
Stoffwechsel
Biosynthese
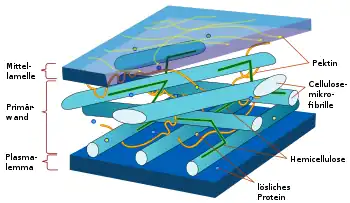
In den meisten Pflanzen hat Cellulose eine grundlegende Bedeutung als Struktursubstanz. Fasern in verholzenden und nichtverholzenden Pflanzen bestehen aus einer Vielzahl von Fibrillen, die wiederum aus zahlreichen, parallel zueinander angeordneten Cellulosemolekülen bestehen. Cellulose-Mikrofibrillen werden in der Plasmamembran einer Zelle in sogenannten Rosettenkomplexen synthetisiert. Diese enthalten das Enzym Cellulose-Synthase, welches β-D-Glucane (D-Glucosepolymere mit β-Bindung) herstellt und dabei das erste Kohlenstoff-Atom eines D-Glucosemoleküls mit dem vierten Kohlenstoff-Atom eines anderen D-Glucosemoleküls verknüpft. Die Herstellung der Glucankette erfordert zwei essentielle Schritte. Zuerst spaltet Saccharose-Synthase das Disaccharid (Zweifachzucker) Saccharose in seine Monomere Glucose und Fructose, um so Glucose bereitzustellen. Die Glucose wird nun durch die Cellulose-Synthase mit Uridindiphosphat (UDP) zu UDP-Glucose verknüpft. In einem weiteren Schritt wird nun die gebundene Glucose auf den nichtreduzierenden Zucker der wachsenden Glucankette übertragen. Anschließend wandert die Glucankette bzw. das Enzym weiter, sodass ein weiterer Syntheseschritt stattfinden kann.
Cellulose wird in der Plasmamembran gebildet und vernetzt sich untereinander zu faserigen Strukturen. Anschließend erfolgt die räumliche Anordnung der Cellulosefibrillen durch Mikrotubuli.
Wichtiges Merkmal der Manteltiere ist ein Cuticularmantel, der von der einschichtigen Epidermis abgeschieden wird und – einmalig im Tierreich – aus Cellulose besteht.[14]
Abbau
Da Pflanzen selbst produzierte Cellulose in ihre Zellwände einbauen, benötigen sie endogene Cellulasen zum Umbau von Zellwänden, z. B. bei Wachstumsvorgängen. Bei dem pflanzlichen Cellulasegen handelt es sich um ein sehr altes Gen.[15]
Nutzung
Hauptsächlich aus Cellulose bestehendes Pflanzenmaterial wird vom Menschen mindestens seit der Altsteinzeit als Brennstoff zum Kochen und Heizen genutzt. Cellulose ist daneben ein wichtiger Rohstoff für stoffliche Nutzungen, aber auch als natürlicher oder zugesetzter Bestandteil von Nahrungs- und Futtermitteln von Bedeutung. Da Cellulose zudem in fast allen Arten pflanzlicher Biomasse vorkommt, ist sie auch in vielen anderen Bereichen wichtig, wie z. B. in Holz (Lignocellulose) als Baustoff etc.
Rohstoff
Cellulose ist ein wichtiger Rohstoff zur Papierherstellung. Als Ausgangsrohstoff dient das lignin- und cellulosereiche Holz. Aus diesem wird einerseits auf mechanischem Weg Holzschliff hergestellt, der für Papier weniger hoher Qualität verwendet wird. Andererseits wird durch chemische Verfahren der Ligninanteil entfernt, wodurch Zellstoff erzeugt wird, der hauptsächlich aus Cellulose besteht und für Papiere höherer Qualität verwendet werden kann.


In der Bekleidungsindustrie werden sowohl natürliche aus Cellulose bestehenden Pflanzenfasern wie auch künstliche Cellulosefasern (abgekürzt CO) verwendet. Beispiele für natürliche Fasern sind Baumwolle und die Bastfasern des Lein (Flachs), die zu Leinen verarbeitet werden.
Zur Herstellung von synthetischen Cellulosefasern („Zellwolle“) wird eine alkalische Lösung von xanthogenierter Cellulose („Viscose-Lösung“) zu Fäden verarbeitet, der sogenannten Regeneratfaser (z. B. Viskose).
Unterschiedlichste Cellulosederivate finden vielfältige Anwendung, wie z. B. Methylcellulose, Celluloseacetat und Cellulosenitrat in der Bau-, Textil- und chemischen Industrie. Vom Cellulosenitrat abgeleitet ist Zelluloid, der erste Thermoplast.
Ein weiteres Cellulose-Regenerat ist Cellophan (Cellulosehydrat), das in Form von Folien ein verbreitetes Verpackungsmaterial ist.
Da Cellulose in der Natur in großen Mengen verfügbar ist, wird versucht, diesen nachwachsenden Rohstoff z. B. auch als Biokraftstoff Cellulose-Ethanol verfügbar zu machen. Derzeit wird intensiv geforscht, um pflanzliche Biomasse, wie vor allem Holz und Stroh, dafür zu erschließen.
Cellulose wird mit Borax oder anderen Fungizid und Flammschutzmittel versetzt als Einblasdämmstoff verwendet.[17] Dazu wird sortiertes Zeitungspapier in einem mechanischen Prozess zunächst zerkleinert und mit Fungiziden sowie Flammschutzmitteln behandelt. Der gewonnene Cellulosedämmstoff kann fugenlos eingeblasen und für die Wärmedämmung und als Schallschutz verwendet werden. Das Einblasverfahren wird in Kanada und den USA seit ca. 1940 angewendet. Vorteil dieses Dämmstoffes ist die umweltschonende Herstellung, bzw. die weitere Verwendung von sortiertem Zeitungspapier.
Im Labor kann es bei der Auftrennung von Stoffgemischen als Füllmaterial für die Säulenchromatographie verwendet werden.
Tiere
Fast alle Tiere – mit Ausnahme weniger Mollusken wie einiger Schnecken,[14] etwa der Weinbergschnecke[18] und weniger Termitenarten[19][20] – einschließlich der meisten Pflanzenfresser können Cellulose im Gegensatz zu Stärke nicht durch eigene Stoffwechselleistungen abbauen, obwohl beide Moleküle aus Traubenzuckermolekülen aufgebaut sind. Diese Tiere besitzen nur die Enzyme, die α-1,4- oder α-1,6-glycosidische Bindungen (z. B. in Stärke) spalten können (Amylasen), nicht aber β-1,4-glycosidische Bindungen der Cellulose (Cellulasen). Deshalb können diese Tiere (z. B. Kühe) den hohen Energiegehalt dieses Kohlenhydrates nur mit Hilfe von endosymbiontischen Mikroorganismen erschließen, die in ihren Verdauungsorganen leben.
Cellulose fressende Tiere ernähren sich dann von der stetig nachwachsenden Symbiontenmasse in ihrem Verdauungssystem. Wiederkäuer verdauen einen großen Teil der Cellulose und anderer Polysaccharide im Pansen mithilfe anaerober Mikroorganismen, die die Cellulose zu Fettsäuren umsetzen. Ähnliches gilt für Pferde und Wassergeflügel, bei denen die Verarbeitung jedoch im Dickdarm stattfindet.
Einige terrestrische Krebse wie die Isopoda können Cellulose mit der Unterstützung endosymbiotischer Mikroorganismen abbauen.[21][22] Dasselbe gilt für Insekten wie Silberfischchen,[23] fast alle Termiten[24][25] oder Schaben.[26] In 200 untersuchten Termitenspezies wurden mehr als 450 unterschiedliche Endosymbionten identifiziert.[27] Endosymbionten fossilierter Termiten wurden bereits aus der Kreidezeit direkt (in burmesischem Bernstein) nachgewiesen.[28]
Mensch
Auch der Mensch besitzt keine Verdauungsenzyme für den Abbau von Cellulose. Mit Hilfe anaerober Bakterien im ersten Teil des Dickdarms, dem Blinddarm und dem aufsteigenden Dickdarm (Colon ascendens) wird ein Teil der Cellulose aus der Nahrung zu kurzkettigen Oligosacchariden abgebaut. Über die Colonschleimhaut werden sie resorbiert und vom Stoffwechsel verwertet. Cellulose ist somit, neben Hemicellulosen, Pektin und Lignin, ein wichtiger pflanzlicher Ballaststoff in der menschlichen Nahrung.
Cellulase-Nachweis aus Tieren (Termiten)
Der Ansicht, dass Tieren grundsätzlich Cellulasen fehlen, widersprechen jedoch Berichte über Cellulase-Nachweise aus Termiten.[29][30][31] Bei einigen Termitenarten (Reticulitermes speratus und Coptotermes formosanus), dem Krebs Cherax destructor, dem Fadenwurm Bursaphelenchus xylophilus sowie den Muscheln Corbicula japonica und Lyrodus pedicellatus wurden Cellulase-Gene nachgewiesen.[32]
Bakterien, Pilze und Flagellaten

Viele Bakterien, Pilze und Flagellaten[33][34] können über ihre Cellulasen die Cellulose nur bis zum Glucosedimer Cellobiose zersetzen. Einige wenige Protozoen und Pilze wie Aspergillus-, Penicillium- und Fusarium-Arten besitzen zusätzlich die notwendigen β-1,4-Glucosidasen oder Cellobiasen, welche die Cellobiose in Glucose aufspalten.[35] Manche holzzersetzenden Pilze wie Ceriporiopsis subvermispora können Cellobiose auch über die Cellobiosedehydrogenase (CDH), ein extrazelluläres Hämoflavoenzym, oxidativ abbauen. Dabei entsteht statt der Glucose Gluconsäure.[36]
Der Abbau der Cellulose durch weitere hydrolytische Enzyme wird unterstützt durch Kohlenhydrat-bindende Bereiche (CBMs) der Enzyme.[37]
Die Grünalge Chlamydomonas reinhardtii kann Cellulose spalten und zur Energiegewinnung nutzen.[38]
Lebensmittelzusatzstoff
Auch in der Nahrungsmittel- und Pharmaindustrie wird Cellulose bzw. werden Cellulosederivate verwendet, z. B. als Verdickungsmittel, Trägerstoff, Füllstoff, Trennmittel, Überzugsmittel und Aufschlagmittel. Als Lebensmittelzusatzstoff trägt Cellulose die Bezeichnungen E 460 bis E 466:
- E 460i – Mikrokristalline Cellulose
- E 460ii – Cellulosepulver
- E 461 – Methylcellulose
- E 463 – Hydroxypropylcellulose
- E 464 – Hydroxypropylmethylcellulose
- E 465 – Ethylmethylcellulose
- E 466 – Carboxymethylcellulose
Der Nachweis erfolgt mittels einer Iod-Zinkchloridlösung (Blaufärbung).
Siehe auch
Literatur
- Hans-Walter Heldt, Birgit Piechulla, Fiona Heldt: Pflanzenbiochemie. 4. Auflage, Spektrum, Heidelberg / Berlin 2008, ISBN 978-3-8274-1961-3.
- Peter Schopfer, Axel Brennicke: Pflanzenphysiologie. 7. Auflage, Spektrum, Heidelberg / Berlin 2010, ISBN 978-3-8274-2351-1.
- Lincoln Taiz, Eduardo Zeiger: Physiologie der Pflanzen. (Originaltitel: Plant physiology übersetzt von Uta Dreßer), Spektrum, Heidelberg / Berlin 2000, ISBN 3-8274-0537-8.
- Dieter Hess: Pflanzenphysiologie. 11. vollständig neu bearbeitete und gestaltete Auflage, UTB 8393 / Ulmer, Stuttgart 2008, ISBN 978-3-8252-8393-3 (UTB) / ISBN 978-3-8001-2885-3 (Ulmer).
- Fumiaki Nakatsubo: Chemical synthesis of Cellulose. In: David N.-S. Hon, Nobuo Shira: Wood and cellulosic chemistry. Ausgabe 2, CRC Press, 2001, ISBN 978-0-8247-0024-9, eingeschränkte Vorschau in der Google-Buchsuche.
Weblinks
- Literatur von und über Cellulose im Katalog der Deutschen Nationalbibliothek
- Prof. Blumes Medienangebot: Nachweisreagenzien, Absatz 13: Iod-Zinkchlorid-Lösung
- x-plainmefood - Polysaccharide: Cellulose & Cellulosederivate, Eigenschaften und Anwendungen von Cellulose und ihren Derivaten
- Hitzebeständiges Enzym für Zelluloseabbau auf g-o.de.
Einzelnachweise
- Eintrag zu CELLULOSE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- Eintrag zu E 460: Cellulose in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 6. August 2020.
- Datenblatt Cellulose, microcrystalline bei Alfa Aesar, abgerufen am 18. Juni 2019 (Seite nicht mehr abrufbar).
- Datenblatt Cellulose bei Merck, abgerufen am 18. Juni 2019.
- Kenji Kamide: Cellulose and Cellulose Derivatives. Elsevier, 2005, ISBN 978-0-08-045444-3, S. 1.
- Volker Storch, Ulrich Welsch: Systematische Zoologie. 6. Auflage. Spektrum Akademischer Verlag, Heidelberg, Berlin 2004, ISBN 3-8274-1112-2, S. 490.
- R. L. Crawford: Lignin biodegradation and transformation. John Wiley and Sons, New York 1981, ISBN 0-471-05743-6.
- Dieter Klemm, Brigitte Heublein, Hans-Peter Fink, Andreas Bohn: Cellulose: Fascinating Biopolymer and Sustainable Raw Material. In: ChemInform. 36. Jahrgang, Nr. 36, 2005, doi:10.1002/chin.200536238.
- Cellulose - Materialinfo auf nanopartikel.info, abgerufen am 3. März 2017.
- A. F. Turbak, F. W. Snyder, K. R. Sandberg: Microfibrillated cellulose, a new cellulose product: Properties, uses and commercial potential. In: J. Appl. Polym. Sci.: Appl. Polym. Symp. (United States), Volume: 37. A. Sarko (Hrsg.): Symposium on Cellulose and Wood as Future Chemical Feedstocks and Sources of Energy, and General Papers. Proceedings of the Ninth Cellulose Conference, 1982, Wiley, New York City 1983, ISBN 0-471-88132-5, S. 815–827.
- Lubert Stryer: Biochemie. 4. Auflage, Spektrum der Wissenschaft Verlag, korrigierter Nachdruck, Heidelberg, 1999, ISBN 3-86025-346-8, S. 497.
- Klaus Ruppersberg, Hanne Rautenstrauch, Stefan Thomsen: Know Thy Carbs! Safer Carbohydrate Detection Methods for School Labs – Part 2. In: ChemViews. 2022, doi:10.1002/chemv.202200023 (chemistryviews.org [abgerufen am 23. Juni 2022]).
- J. Zhang u. a.: Application of ionic liquids for dissolving cellulose and fabricating cellulose-based materials: state of the art and future trends. In: Materials Chemistry Frontiers Ausgabe 7, 2017. doi:10.1039/C6QM00348F
- Eintrag zu Cellulose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. August 2013.
- Angus Davison, Mark Blaxter: Ancient origin of glycosyl hydrolase family 9 cellulase genes. In: Molecular Biology and Evolution. Band 22, Nr. 5, 2005, S. 1273–1284, doi:10.1093/molbev/msi107.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich, 2006, ISBN 978-3-906390-29-1, S. 346.
- Fraunhofer Informationszentrum Raum und Bau (Baufachinformation.de): Organische Dämmstoffe.
- Fay L. Myers and D. H. Northcote: Partial Purification and some Properties of a Cellulase from Helix pomatia. Department of Biochemistry, University of Cambridge, 23. Juli 1958, In: Biochemical Journal. 71 (4), Apr. 1959, 749–756, doi:10.1042/bj0710749.
- H. Watanabe, Hiroaki Noda, G. Tokuda, N. Lo: A cellulase gene of termite origin. In: Nature. 394, S. 330–331, 1998, doi:10.1038/28527.
- Andreas Brune und Moriya Ohkuma: Role of the termite gut macrobiota in symbiotic digestion. In: David Edward Bignell u. a.: Biology of Termites: A Modern Synthesis. 2. Auflage, Springer, 2011, ISBN 978-90-481-3976-7, Kapitel 16, doi:10.1007/978-90-481-3977-4_16.
- M. Zimmer u. a.: Cellulose digestion and phenol oxidation in coastal isopods (Crustacea: Isopoda). In: Marine Biology. Band 140, Nr. 6, 2002, S. 1207–1213; doi:10.1007/s00227-002-0800-2.
- Martin Zimmer, Werner Topp: Microorganisms and cellulose digestion in the gut of the woodlouse Porcellio scaber. In: Journal of Chemical Ecology. Band 24, Nr. 8, 1998, S. 1397–1408; doi:10.1023/A:1021235001949.
- N. Chakraborty, G. M. Sarkar, S. C. Lahiri: Cellulose degrading capabilities of cellulolytic bacteria isolated from the intestinal fluids of the silver cricket. In: Environmentalist. Band 20, Nr. 1, 2000, S. 9–11, doi:10.1023/A:1006691524607.
- Moriya Ohkuma: Symbioses of flagellates and prokaryotes in the gut of lower termites. In: Trends in Microbiology. 16(7): 2008, 345–362, doi:10.1016/j.tim.2008.04.004.
- Andreas Brune, Ulrich Stingl: Procaryotic symbionts of termite gut flagellates: Phylogenetic and metabolic implications of a tripartite symbiosis. doi:10.1007/3-540-28221-1_3, In: Jörg Overmann (Hrsg.): Progress in Molecular and Subcellular Biology. Band 41. Springer Verlag, 2005, ISBN 3-540-28210-6.
- Michael Slaytor: Cellulose digestion in termites and cockroaches: what role do symbionts play? In: Comparative Biochemistry and Physiology Part B: Comparative Biochemistry. Band 103, Nr. 4, 1992, S. 775–784, doi:10.1016/0305-0491(92)90194-V.
- Michael A. Yamin: Flagellates of the orders Trichomonadida Kirby, Oxymonadida Grasse, and Hypermastigida Grassi & Foa reported from lower termites (Isoptera families Mastotermitidae, Kalotermitidae, Hodotermitidae, Termopsidae, Rhinotermitidae, and Serritermitidae) and from the wood-feeding roach Cryptocercus (Dictyoptera: Cryptocercidae). In: Sociobiology. Band 4, 1979, S. 113–117, OCLC 800236058.
- George O Poinar Jr: Description of an early cretaceous termite (Isoptera: Kalotermitidae) and its associated intestinal protozoa, with comments on their co-evolution. In: Parasites & Vectors. Band 2, 2009, S. 12, doi:10.1186/1756-3305-2-12.
- K. Nakashima u. a.: Dual cellulose-digesting system of the wood-feeding termite, Coptotermes formosanus Shiraki. In: Insect Biochemistry and Molecular Biology. Band 32, Nr. 7, 2002, S. 777–784, doi:10.1016/S0965-1748(01)00160-6.
- Michael M. Martin, Joan S. Martin: Cellulose digestion in the midgut of the fungus-growing termite Macrotermes natalensis: The role of acquired digestive enzymes. In: Science. Band 199, Nr. 4336, 1978, S. 1453–1455, doi:10.1126/science.199.4336.1453.
- Hirofumi Watanabe u. a.: A cellulase gene of termite origin. In: Nature. Band 394, Nr. 6691, 1998, S. 330–331, doi:10.1038/28527.
- EC 3.2.1.4 - cellulase bei BRENDA, abgerufen am 9. August 2013.
- William Trager: The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. In: The Biological Bulletin. Band 66, Nr. 2, 1934, S. 182–190, JSTOR:1537331.
- Michael A. Yamin: Cellulose metabolism by the flagellate Trichonympha from a termite is independent of endosymbiotic bacteria. In: Science. Band 211, Nr. 4477, 1981, S. 58–59, doi:10.1126/science.211.4477.58.
- M. Weidenbörner: Lexikon der Lebensmittelmykologie. Springer, 1999, ISBN 978-3-540-65241-0.
- E. Duenhofen: Fermentation, purification and characterization of cellobiose dehydrogenase from Ceriporiopsis subvermispora. Diplomarbeit an der Universität für Bodenkultur Wien, 2005, AC04548818.
- Anthony W. Blake u. a.: Understanding the biological rationale for the diversity of cellulose-directed carbohydrate-binding modules in prokaryotic enzymes. In: Journal of Biological Chemistry. Band 281, Nr. 39, 2006, S. 29321–29329, doi:10.1074/jbc.M605903200.
- Olga Blifernez-Klassen, Viktor Klassen u. a.: Cellulose degradation and assimilation by the unicellular phototrophic eukaryote Chlamydomonas reinhardtii. In: Nature Communications. 3, Artikel: 1214, 2012, doi:10.1038/ncomms2210, Pflanzen fressen Pflanzen auf pflanzenforschung.de, abgerufen am 3. März 2017.