Dunkelfeldmikroskopie
Die Dunkelfeldmikroskopie ist eine bereits seit über 250 Jahren bekannte Variante der Lichtmikroskopie. Sie führt zu einem dunklen Bildhintergrund, vor dem sich die zu beobachtenden Strukturen hell abheben. Dadurch können von durchsichtigen Objekten mit nur sehr geringem Kontrast dennoch gut aufgelöste, kontrastreiche Bilder erzeugt werden, ohne dass eine vorherige Färbung des Präparats erforderlich ist. Auch lebende Objekte sind gut beobachtbar. Bis zur Entwicklung der Phasenkontrastmikroskopie in den 1930er Jahren war die Dunkelfeldmikroskopie neben der ähnlichen Kontrastfarben-(„Rheinberg“)-Beleuchtung (siehe unten) und der schiefen Beleuchtung (vgl. Kreutz-Blende) die einzige Methode zur Kontrastverstärkung bei ungefärbten Präparaten. In Abgrenzung zur Dunkelfeldmikroskopie wird die Technik der „normalen“ Lichtmikroskopie als Hellfeldmikroskopie bezeichnet.


Das Prinzip der Dunkelfeldmikroskopie beruht darauf, dass Objekte Licht nicht nur absorbieren, sondern auch immer einen Teil des Lichtstrahls ablenken. Wenn die Beleuchtung so eingestellt ist, dass die direkten Lichtstrahlen am Objektiv des Mikroskops vorbeigehen, sieht der Betrachter nur das abgelenkte Licht. Eine der Ablenkungsursachen ist die als Tyndall-Effekt bezeichnete Streuung von Licht an kleinen Teilchen, welche beispielsweise auch zu beobachten ist, wenn Licht in einen dunklen Raum fällt und der Staub innerhalb des Lichtstrahls deutlich sichtbar wird. Auch Teilchen, die kleiner sind als die Auflösungsgrenze des Mikroskops, lenken Licht ab und lassen sich daher mit einem Dunkelfeldmikroskop nachweisen. Manche Eigenschaften wie die Beweglichkeit von Teilchen lassen sich so untersuchen. Diese Anwendung hatte Anfang des 20. Jahrhunderts als Ultramikroskopie größere Bedeutung.
Die Beleuchtung des Präparats kann vom Objektiv aus gesehen von hinter dem Präparat erfolgen (Durchlicht) oder von der Objektivseite (Auflicht) oder auch seitlich, wie dies beim Spaltultramikroskop der Fall ist. Durchlicht- und Auflicht-Dunkelfeld sind sowohl in „normalen“ Mikroskopen als auch in Stereomikroskopen möglich.
Vergleich von Hellfeld und Dunkelfeld


Hell- und Dunkelfeld bei Durchlichtbeleuchtung
Als Durchlichtbeleuchtung wird in der Mikroskopie eine Anordnung bezeichnet, bei der die Beleuchtung vom Objektiv aus gesehen von der Rückseite des Präparats erfolgt, das Licht durch das Präparat durchtritt (Transmission) und schließlich in das Objektiv gelangt. Die normale Durchlicht-Mikroskopie, genauer: Durchlicht-Hellfeldmikroskopie, ist die am häufigsten in der Biologie und Medizin eingesetzte Variante[1], sie findet auch in Schulmikroskopen Anwendung.
Bei der klassischen Durchlicht-Hellfeldmikroskopie entsteht der Bildkontrast hauptsächlich dadurch, dass das Präparat einen Teil des eingestrahlten Lichts absorbiert und so der entsprechende Bereich dunkler erscheint (vergleiche Abbildung 1). Viele mikroskopische Objekte sind aber weitgehend durchsichtig oder sehr klein und absorbieren daher nur sehr wenig Licht. Sie erzeugen im Hellfeldmikroskop nur einen geringen Kontrast und sind somit vor dem hellen Hintergrund schlecht zu erkennen (vergleiche Abbildung 2 links). Derartige Objekte können Licht ablenken, also die Richtung einiger Lichtstrahlen durch Streuung, Beugung, Brechung und/oder Reflexion verändern. Unter Hellfeldbeleuchtung lassen sich diese Ablenkungen aber kaum feststellen, da die Helligkeit der abgelenkten Lichtstrahlen viel schwächer ist, als der hell erleuchtete Bildhintergrund. In gewissen Grenzen kann der Kontrast bei Hellfeldbeleuchtung erhöht werden, indem eine kleinere Blende im Strahlengang der Beleuchtung (Kondensorblende) gewählt wird (vergleiche Abbildung 2 Mitte). Gleichzeitig verstärken sich dadurch aber auch Abbildungsfehler und es entstehen am Rand der Objekte störende Beugungsmuster (vergleiche kleine Bildausschnitte in Abbildung 2).
Bei der Durchlicht-Dunkelfeldmikroskopie wird das Präparat von der Rückseite so beleuchtet, dass die Beleuchtung nicht direkt in das Objektiv gelangt, sondern nur das im Präparat abgelenkte Licht. Der Hintergrund des Bildes erscheint somit dunkel, während Objekte im Präparat hell erscheinen (vergleiche Abbildung 1 rechts). Dies funktioniert auch und besonders bei weitgehend transparenten Proben. Während die Helligkeitsunterschiede des abgelenkten Lichts wegen der hohen Lichtintensität der Hellfeldabbildung schwer zu erkennen sind, erscheinen diese Unterschiede in der Dunkelfeldabbildung deutlich stärker. Die feinen Fettspuren eines Fingerabdrucks in Abbildung 2 (rechts) sind daher klar zu erkennen. Die schon bei Hellfeldbeleuchtung erkennbaren Verunreinigungen (Partikel und Kratzer) zeigen im Dunkelfeld jedoch einen so starken Kontrast, dass sie im Bild nur noch als helle, überstrahlte Flecken abgebildet werden.
Bei Durchlicht-Dunkelfeldbeleuchtung ist es besonders wichtig, dass Objektträger, Deckglas und auch die Glasoberflächen im Mikroskop sauber sind, da jedes Staubkorn durch seine Ablenkung des Lichts zum Hintergrundrauschen beiträgt. Auch dürfen lichtablenkende Strukturen nicht in verschiedenen Ebenen übereinander vorkommen, da sich deren Signale sonst überlagern. Dementsprechend ist Dunkelfeldbeleuchtung nicht geeignet für dickere Präparate wie typische Gewebeschnitte.[1]
Physikalisch lässt sich Durchlicht-Dunkelfeldbeleuchtung als eine Beleuchtung beschreiben, bei der das Beugungshauptmaximum des Lichts (siehe Beugungsscheibchen) nicht in die hintere Brennebene des Objektivs gelangt. Nur abgelenktes Licht, beispielsweise durch Beugung entstandene Nebenmaxima, nehmen am Bildaufbau teil.[1][2]
Hell- und Dunkelfeld bei Auflichtbeleuchtung

Von Auflichtbeleuchtung spricht man in der Lichtmikroskopie, wenn das Licht von oben (genauer: von der Objektivseite aus) auf das Präparat fällt. Die Beleuchtung erfolgt entweder durch das Objektiv selbst hindurch oder durch eine eigenständige Beleuchtungseinrichtung, die seitlich oder um das Objektiv herum angeordnet ist. Der Winkel, in dem das Licht auf das Objekt fällt, bestimmt das Aussehen des Bildes. Wird ein Großteil des von der Probe gerichtet reflektierten Lichts vom Objektiv eingefangen, so erscheint das Objekt in der Abbildung hell (Hellfeldbeleuchtung). Erfolgt die Beleuchtung jedoch so weit von der Seite, dass das gerichtet reflektierte Licht am Objektiv vorbei strahlt, spricht man von Dunkelfeldbeleuchtung.
Bei Materialuntersuchungen ist die Hellfeld-Beleuchtung die am häufigsten verwendete Technik für die Ausleuchtung von rauen, wenig reflektierenden Objekten.[3] Die Auflicht-Hellfeldbeleuchtung entspricht der normalen Sehweise des Menschen: Glatte, stark reflektierende Oberflächen erscheinen aufgrund ihres starken Glanzes hell (Abbildung 3 links). Die Reflexion verleiht Metalloberflächen den typischen Glanz. Unterhalb von Glas oder anderen transparenten Oberflächen angeordnete Strukturen wären bei dieser Beleuchtungsart durch die starke Reflexion an der Oberfläche nur schlecht zu erkennen.
Bei Auflicht-Dunkelfeldbeleuchtung erscheinen glatte, stark reflektierende Flächen dunkel. Kanten und Oberflächendefekte wie Kratzer oder Auflagerungen leuchten jedoch hell (Abbildung 3 rechts). Diese werden stark hervorgehoben und können leichter erkannt, bzw. mit bildverarbeitenden Verfahren einfacher detektiert werden. Bei rauen, wenig reflektierende Oberflächen sorgt die seitliche Anordnung der Auflicht-Dunkelfeldbeleuchtung für lokale Schattenbildung, so dass Oberflächenstrukturen etwas plastischer wirken. Dieser Effekt kann durch eine einseitige Beleuchtung noch deutlich verstärkt werden.
Dunkelfeldmikroskopie außerhalb der Lichtmikroskopie
Die Begriffe Dunkelfeld und Hellfeld lassen sich auch auf mikroskopische Verfahren übertragen, die zur Bilderzeugung kein Licht, sondern andere Signale verwenden. Es wird entsprechend unterschieden, ob nicht abgelenktes Anregungssignal vom Detektor registriert wird (Hellfeld), oder ob nur das von der Probe veränderte Signal zur Bildgebung beiträgt (Dunkelfeld). Mit Dunkelfeld bezeichnete Verfahren gibt es zum Beispiel in der Elektronenmikroskopie (siehe etwa Rastertransmissionselektronenmikroskop) und in der Akustischen Mikroskopie.[4]
Dunkelfeldbeleuchtung in heutigen Durchlichtmikroskopen
Die einfachste Möglichkeit mit einem normalen Durchlichtmikroskop mit Lichtquelle, Kondensor und Objektiv bei Köhlerscher Beleuchtung eine Dunkelfeldbeleuchtung zu erzeugen, besteht darin, die Kondensorblende eng zu schließen und anschließend so lange seitlich zu verschieben, bis kein direktes Licht mehr in das Objektiv eindringt. Die Beleuchtung erfolgt hier demnach nur von einer Seite. Jedoch bieten gerade neuere Mikroskope häufig keine Möglichkeit, die Blende relativ zum Kondensor zu bewegen.[2]
Gemeinsame Grundlagen
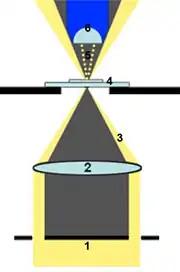
Bessere Bildqualitäten werden bei zentriertem Kondensor mit Hilfe einer Zusatzeinrichtung erreicht. Diese Zusatzeinrichtung beschränkt die Beleuchtung des Präparats auf einen Kegelmantel (gelb in der Schemazeichnung rechts). Der innere Teil des Kegels enthält kein Licht (grau in der Schemazeichnung). Der vom Kondensor kommende Kegelmantel wird in die Präparatebene fokussiert und weitet sich im einfachsten Fall danach wieder, so dass nicht abgelenktes Licht vollständig an der Objektivöffnung vorbeigeht, der Bildhintergrund bleibt dunkel. Nur Licht, das durch die zu beobachtenden Objekte abgelenkt wird, gelangt in das Objektiv und erzeugt ein Bild mit hellen Strukturen auf dunklem Hintergrund. Alle heutigen Durchlicht-Dunkelfeldbeleuchtungen erzeugen einen Kegelmantel, jedoch treten diese nicht immer durch das ganze Präparat hindurch: In manchen Fällen kommt es zur Totalreflexion des nicht abgelenkten Lichts an der Deckglasoberkante.
Um den Beleuchtungskegelmantel zu erzeugen, werden zwei verschiedene Verfahren angewendet. Eine Zentralblende zur Erzeugung des Kegelmantels ist einfach in der Herstellung und Handhabung, preisgünstig und daher weit verbreitet. Dieses Verfahren eignet sich besonders für Objektive mit relativ geringer Vergrößerung, wobei die Dicke des Beleuchtungskegelmantels durch einfaches Wechseln der Blende optimal auf das verwendete Objektiv abgestimmt werden kann. Spezielle Dunkelfeldkondensoren erreichen durch Spiegeltechniken eine höhere Lichtausbeute und können durch Immersion auch den Anforderungen höher vergrößernder Objektive gerecht werden. Die Abbildungsqualität wird besser.
Wenn der Beleuchtungskegelmantel wie in der Schemazeichnung durch das Präparat hindurch tritt, so muss er außen am Objektiv vorbeigehen. Eine Dunkelfeld-Beleuchtung ist nur dann möglich, wenn der Winkel des aus dem Kondensor austretenden Lichts (Öffnungswinkel) größer ist als der Winkel des vom Objektiv aufgefangenen Lichts. Je größer der Öffnungswinkel eines Objektivs oder Kondensors, desto besser ist die maximal erzielbare Auflösung. Statt des Öffnungswinkels wird bei Objektiven und Kondensoren die numerische Apertur angegeben, die ohne Immersion bis zu 0,95 betragen kann und mit Ölimmersion bis etwa 1,4. Für Dunkelfeldbeleuchtung muss also die numerische Apertur des Kondensors höher sein als die des verwendeten Objektivs. Ohne Immersion des Kondensors ist die Anwendung daher auf Objektive mit einer numerischen Apertur von etwa 0,75 oder weniger beschränkt.[5] 40x-Objektive, die ohne Immersion verwendet werden, haben häufig eine numerische Apertur von 0,65.
Beleuchtung mit Zentralblende


Hier wird eine ringförmige Blende in einem ansonsten normalen Durchlicht-Hellfeldmikroskop verwendet. Diese Zentralblende (1 in der oberen Schemazeichnung rechts) weist einen lichtdurchlässigen Rand oder Ring auf und reduziert damit die Beleuchtung mit Hilfe eines normalen Kondensors (2) auf einen Kegelmantel (3). Um den Öffnungswinkel des Kondensors optimal auszunutzen, wird ein möglichst weit außen liegender Teil des Kondensors verwendet. Je größer der Öffnungswinkel des verwendeten Objektivs ist, desto größer muss auch der Durchmesser der zentralen lichtundurchlässigen Fläche sein, die Beleuchtungsstärke verringert sich entsprechend. Vom Objekttisch mit dem Objektträger (4) ausgehend verläuft das Licht somit am Objektiv (6) vorbei. Nur von Strukturen im Präparat abgelenktes Licht (5) gelangt in das Objektiv. Die Zentralblende kann als Einschub unter die Kondensorlinse eines normalen Durchlichtmikroskops eingesetzt werden.[1][5][6]
Die weiter verbreitete Phasenkontrastmikroskopie beruht zwar auf einem völlig anderen optischen Phänomen, aber auch dort werden Blenden verwendet. Diese Ringblenden lassen sich manchmal als Dunkelfeldblenden zweckentfremden. Phasenkontrast-Ringblenden sind so angelegt, dass der Lichtkegel bei richtiger Einstellung in das Objektiv eintritt und nicht daran vorbei geht, wie dies für Dunkelfeld erforderlich ist. Daher lassen sich für ein gegebenes Objektiv nur solche Phasenkontrast-Ringblenden als Dunkelfeld-Blenden einsetzen, die eigentlich für Objektive mit deutlich größerem Öffnungswinkel (höherer numerische Apertur) gedacht sind. Beispielsweise eignet sich eine Phasenkontrast-Ringblende für ein 100x-Ölimmersionsobjektiv in der Regel als Dunkelfeldblende für 10x- und 20x-Trockenobjektive, da Ölimmersionsobjektive einen größeren Öffnungswinkel haben.[5]
Dunkelfeldkondensoren

Bei besonders hohen Ansprüchen an die Abbildungsqualität werden statt Zentralblenden spezielle Dunkelfeldkondensoren eingesetzt. Es gibt Trockendunkelfeldkondensoren und Immersionsdunkelfeldkondensoren, bei letzteren wird Immersionsöl oder Wasser zwischen den Kondensor und den Objektträger eingebracht. Dadurch ist eine höhere numerische Apertur und damit eine höhere Auflösung möglich. Auch liefert ein Immersionskondensor einen besseren Kontrast, da Reflexe an der Objektträgerunterseite und Kondensoroberfläche vermieden werden, die zu einer Aufhellung des Bildhintergrundes führen.[6] Seine Handhabung ist jedoch aufwändiger, auch weil Öl sorgfältige Reinigungsarbeiten erforderlich macht. Der Nachteil beider Dunkelfeldkondensorarten gegenüber einer Zentralblende ist der aufwändigere Wechsel zu einer Hellfeldbeleuchtung, da der Kondensor hierfür ausgetauscht werden muss. Trockendunkelfeldkondensoren sind für Objektive mit numerischen Aperturen bis zu 0,65 oder 0,75 geeignet, während Immersionskondensoren für Objektive mit numerischen Aperturen bis zu 1,2 verwendet werden können.[6][5]
Moderne Dunkelfeldkondensoren sind meist Kardioidkondensoren.[6][7] Hier leitet ein konvex gewölbter zentraler Spiegel das eintreffende Licht nach außen auf einen rundherum laufenden konkaven Spiegel, so dass der Kegelmantel erzeugt wird (siehe vergleichbare Zeichnung von 1910 rechts). Der konkave Spiegel hat idealerweise eine wie eine Kardioide geformte Oberfläche, daher der Name. Aus fertigungstechnischen Gründen wird diese Oberfläche jedoch als Kugelfläche ausgeführt, ohne dass dies zu nennenswerten Qualitätseinbußen führt. Ein Paraboloidkondensor hat dagegen die Form eines abgeschnittenen Paraboloids. Das Licht wird hier nur einmal abgelenkt, nämlich durch Totalreflexion (siehe Zeichnung von Wenhams Glasparaboloid weiter unten), wodurch wiederum ein rundum verlaufender Beleuchtungskegelmantel erzeugt wird.[6][7][8]
Um sicherzustellen, dass die numerische Apertur des Objektivs kleiner ist, als die des Kondensors, kann ergänzend ein Objektiv eingesetzt werden, bei dem über eine bewegliche Irisblende die numerische Apertur eingeschränkt werden kann. Der Öffnungswinkel des Objektivs kann damit optimal auf den Durchmesser des Beleuchtungskegels abgestimmt werden, um letzteren gerade noch ausblenden zu können.[5][8]
Kardioid- und Paraboloidkondensoren werden auch als katoptrische Dunkelfeldkondensoren bezeichnet, da in ihnen die Lichtablenkung durch Spiegelung erfolgt, während dies in den sogenannten dioptrischen Kondensoren durch Glaslinsen geschieht.[9]
Durchlicht-Dunkelfeld in Stereomikroskopen
Auch für Stereomikroskope sind Durchlicht-Dunkelfeld-Beleuchtungen verfügbar. Die Beleuchtungseinrichtung ist im Stativfuß untergebracht. Abgesehen von der eigentlichen Lichtquelle, z. B. einer Halogenlampe, werden eine zentrale Abdeckung und außen liegende, aufrecht stehende spiegelnde Oberflächen eingesetzt, um die Beleuchtung des Objekts mit einem Kegelmantel zu ermöglichen. Das Prinzip entspricht also in etwa dem oben beschriebenen Spiegelkondensor. Das Objekt wird auf eine Glasplatte gelegt, die den Stativfuß nach oben abschließt. Das Bild setzt sich zusammen aus Lichtstrahlen, die im Objekt durch Reflexion, Lichtbrechung oder Beugung abgelenkt wurden. Typischerweise kann die zentrale Abdeckung gegen eine Mattscheibe ausgewechselt werden, so dass neben Dunkelfeld auch Hellfeld-Durchlichtbeleuchtung möglich ist. Die außen stehenden Spiegel leiten dann zwar noch genauso viel Licht schräg auf das Präparat wie vorher, durch die sehr viel hellere Hellfeldbeleuchtung führt dies jedoch nicht mehr zu sichtbaren Effekten.[10]



Frühere Ansätze zur Durchlicht-Dunkelfeldbeobachtung
Vor 1900

Schon im 17. Jahrhundert wurde Dunkelfeldmikroskopie von Antoni van Leeuwenhoek, Robert Hooke und Christiaan Huygens angewendet, um Blutbestandteile oder Kleinlebewesen zu beobachten. Dabei wurden jedoch keine speziellen Gerätschaften eingesetzt. Vielmehr wurde die Lichtquelle, etwa eine Kerze, so positioniert, dass kein direktes Licht auf das Objektiv fiel.[5]
Schon mit einem sehr schräg gestellten Beleuchtungsspiegel ist Dunkelfeldmikroskopie möglich. Der Erste, der eine besondere Apparatur für die Dunkelfeldbeleuchtung beschrieb, war 1837 Joseph Bancroft Reade[11] (1801–1870), dessen Verfahren in John Quecketts „Practical treatise on the use of the microscope“ 1852 als Background Illumination bezeichnet wurde.[12] Die Lichtquelle wurde seitlich platziert, eine Sammellinse fokussierte das Licht so auf das Präparat, dass nicht abgelenktes Licht am Objektiv vorbei geleitet wurde. Im Laufe des 19. Jahrhunderts wurden von einer Reihe von Autoren weitere Beleuchtungsapparaturen entwickelt. Da Brechung an Glasoberflächen chromatische Aberration hervorruft, die bei Dunkelfeldmikroskopie besonders störend ist, wurden auch Spiegelkondensoren entwickelt, da bei Spiegelung dieser Fehler nicht auftritt. Die Spiegelung wurde entweder durch reflektierende Oberflächen erreicht, oder durch Totalreflexion.[13][14]
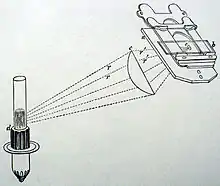
Francis Herbert Wenham (1824–1908) beschrieb zwischen 1852 und 1856 in mehreren Arbeiten verschiedene Dunkelfeld-Beleuchtungsprinzipien. Neben einer seitlichen Beleuchtung (mit Wirkung ähnlich wie bei Reade) gehörten Kondensoren für eine zentral positionierte Beleuchtungsquelle dazu, darunter ein hohler, versilberter Paraboloid und ein massiver Glasparaboloid, in dem die Reflexion durch Totalreflexion zu Stande kam (siehe Abbildung). Hierbei hatte der Objektträger direkten Kontakt mit dem Kondensor. Das Präparat war in Kanadabalsam oder Flüssigkeit eingebettet. Zwischen dem Deckglas und dem Objektiv war Luft. Das Prinzip der Beugung, das wesentlich für eine effektive Dunkelfeldbeleuchtung kleiner Objekte ist, war damals noch nicht verstanden. Wenham nahm daher an, dass die beobachteten Effekte darauf zurückzuführen seien, dass das Objekt von oben beleuchtet wurde, nämlich durch Licht, das von der oberen Deckglaskante durch Totalreflexion auf das Präparat zurückgeworfen wurde.[15][13][14]
Ab ca. 1900
Bis zum Ende des 19. Jahrhunderts wurde Dunkelfeldmikroskopie zwar von Amateuren, aber wenig im wissenschaftlichen Bereich eingesetzt, da sie nicht mit höher auflösenden Objektiven (mit hoher numerischer Apertur) funktionierte. Durch die Arbeiten von Ernst Abbe wurden Ende des 19. Jahrhunderts die optischen Grundlagen wie die Beugung verstanden. Dies nutzte W. Gebhardt bei Zeiss, indem er für die Dunkelfeldbeleuchtung eine Zentralblende für den Abbe’schen Beleuchtungsapparat vorschlug, die Zeiss 1898 ins Programm nahm. Wurde Immersion zwischen Kondensor und Objektträger verwendet, konnten Trockenobjektive mit einer Apertur bis zu 0,95 eingesetzt werden. Zeitweise wurde diese Zentralblende bei allen entsprechenden Geräten mitgeliefert, da sie jedoch bei den Kunden wenig Anklang fand, wurde dies wieder eingestellt. Die Firma Wiener Mikroskopfirma Reichert bot eine ähnliche Lösung an.[13]
Durch die Entdeckung des Syphilis-Erregers erlebte die Dunkelfeldmikroskopie ab 1906 einen Aufschwung, da sie eine gute Darstellung lebender Spirochäten ermöglichte, zu denen der Erreger gehört. Mehrere große Mikroskopfirmen entwickelten verbesserte Dunkelfeldkondensoren. Der von Karl Reichert enthielt eine Zentralblende mit veränderlicher Größe. Henry Siedentopf entwickelte 1907 für Zeiss einen Paraboloid-Kondensor. Das Design entsprach zwar dem Glasparaboloid von Wenham mit einer Abdunklung im Zentrum der unteren Seite des Paraboloids, durch verbesserte Fertigungstechniken konnte die optische Qualität jedoch so gesteigert werden, dass die innere und äußere Apertur des Beleuchtungskegelmantels 1,1 und 1,4 betrugen. Auf Grund der Arbeiten Abbes war klar, dass die Beugung entscheidenden Anteil an der Bildentstehung hat und dass die Totalreflexion am Deckglas lediglich hilft, den Eintritt von nicht abgelenktem Licht ins Objektiv zu vermeiden.[16] Bei einer späteren Ausführung, dem sogenannten Helldunkelfeldkondensor, konnte die zentrale Abdunklung über einen Hebel entfernt werden, so dass ein schneller Wechsel zwischen Dunkel- und Hellfeld möglich war.[2]
Bisher beschriebene Ansätze beruhen darauf, dass die Beleuchtung des Präparats mit einer höheren numerischen Apertur, also mit einem breiteren Winkel, erfolgt, als sie vom Objektiv aufgenommen werden kann. Aber auch der umgekehrte Ansatz ist möglich: Das Präparat wird mit einem vollständigen Kegel einer geringen numerischen Apertur (beispielsweise 0,2) beleuchtet. Hierbei lassen sich auch höchstauflösende Objektive einsetzen, denn die numerische Apertur und damit der Öffnungswinkel können beliebig groß sein, sie müssen allerdings deutlich größer sein als die der Beleuchtung. Das im Präparat nicht abgelenkte Licht wird dann im Objektiv nur einen zentralen Bereich einnehmen, während der äußere Bereich frei von direktem Beleuchtungslicht bleibt. Das nicht abgelenkte Licht wird quasi nachträglich im oder hinter dem Objektiv an einer geeigneten Stelle im Strahlengang entfernt. Dies wurde als „konaxiale Anordnung“ oder als „Zentrales Dunkelfeld“[13] bezeichnet und zu den ultramikroskopischen Methoden (siehe unten) gezählt. Nachteil dieses Ansatzes ist, dass im Präparat wesentlich höhere Lichtstärken erreicht werden als beispielsweise bei einer Zentralblende im Kondensor, wodurch in Präparaten mit vielen Objekten störende Nebenbeugungsbilder entstehen.[13][5]
Henry Siedentopf verwendete für ein derartiges von ihm entwickeltes System ein Objektiv, bei dem die sonst halbkugelförmige Rückseite der Frontlinse (der erste Glaskörper im Objektiv) flach geschliffen und schwarz lackiert war. Carl Metz (1861–1941)[17] bei Leitz entwickelte 1905 ein System mit Ölimmersionsobjektiven, bei dem eine Stempelblende (auch: Trichterblende) von der Rückseite beweglich in das Objektiv eingeführt wurde. Dadurch war es möglich, das gleiche Objektiv ohne diese Blende für Hellfeld-Anwendungen einzusetzen, ohne dass Helligkeitsverluste auftraten. Dafür war die Justierung schwierig.[13]

Wladimir Sergejewitsch Ignatowski entwickelte für Leitz einen Dunkelfeldkondensor, der zwei spiegelnde Oberflächen besaß aber einfacher zu handhaben war als frühere entsprechende Modelle (siehe Schemazeichnung von 1910 weiter oben). Er wurde ab 1907 verkauft. Die Querschnittszeichnung des von Felix Jentzsch entwickelten Nachfolgemodells von 1910 wurde Vorlage für ein Leitz-Logo, den sogenannten Leitz-Sarg.
Auch Henry Siedentopf bei Zeiss entwarf einen Kondensor mit zwei spiegelnden Flächen, der dem weiterentwickelten Kondensor von Ignatowski sehr ähnelte. Aus theoretischen Gründen sollte die zweite spiegelnde Oberfläche einem Ausschnitt einer Kardioiden entsprechen. Kardioide Oberflächen waren aber nur schwierig herzustellen. Stattdessen wurde eine kugelige Oberfläche verwendet, die innerhalb der Fertigungstoleranzen den gleichen Effekt hervorrief. Trotzdem wurde das Gerät von Zeiss als Kardioidkondensor vermarktet.[13]
Vor- und Nachteile der Durchlicht-Dunkelfeldbeleuchtung im Überblick
Vorteile:
- Kleine, auch ungefärbte, Objekte können mit starkem Kontrast beobachtet werden, besonders gut in geringer Konzentration bei dünnen Präparaten.
- Auch Objekte unter der Auflösungsgrenze verursachen Signale, wenn die Beleuchtung stark genug ist.[1]
- Einige Formen der Dunkelfeldbeleuchtung, besonders bei niedriger Vergrößerung, sind sehr einfach und ohne nennenswerte Kosten zu realisieren.
- Bei Dunkelfeldbeleuchtung kommen im Gegensatz zur Hellfeldbeleuchtung keine entoptischen Erscheinungen vor. Dabei handelt es sich um Schlieren, die im Glaskörper des Augevorhanden sind („Mouches volantes“) und Schatten auf die Netzhaut werfen.[2]
Nachteile:
- Zwar verursachen Oberflächen von Objekten durch den Brechungsindexwechsel Signale, nicht aber ein homogenes Inneres, so dass dann im Bild auch nur die Umrandung zu sehen ist.
- Für dickere Präparate oder Präparate mit vielen Objekten ist die Technik wenig geeignet, da dann Überstrahlungen bzw. Streulicht aus verschiedenen Schärfeebenen dem Dunkelfeld-Effekt entgegenwirken.[1]
- Verunreinigungen im Strahlengang führen ebenfalls zu störenden Signalen, daher sind die Anforderungen an die Sauberkeit von Gerät und Präparat sehr hoch.
- Für höhere Ansprüche sind spezielle Kondensoren erforderlich, da die Reflexionen zwischen den verschiedenen Linsen in normalen Kondensoren den Dunkelfeld-Effekt verringern.
- Da entweder der Öffnungswinkel (Apertur) des Kondensors vergrößert (technisch schwierig), oder die Apertur des Objektives (z. B. durch Einhängeblenden) verringert werden muss, ist die Auflösung im Vergleich zu Hellfeld und zu anderen kontrastverstärkenden Methoden wie Phasenkontrast und Differentialinterferenzkontrast reduziert.
Rheinbergbeleuchtung



Die Rheinbergbeleuchtung (auch: optische Färbung oder Kontrastfarbenbeleuchtung) ist eine Abwandlung der Dunkelfeldmikroskopie mit Zentralblende, die 1896 in London von Julius Rheinberg erstmals beschrieben wurde. Die Zentralblende wird dabei durch einen runden Filter mit zwei Farben in konzentrischer Anordnung ersetzt: Eine Farbe bildet einen äußeren Ring, er entspricht dem Ring in der herkömmlichen Ringblende. Das hier durchtretende Licht wird also nur dann ins Objektiv fallen, wenn es im Präparat abgelenkt wird. Im mittleren, sonst lichtundurchlässigen Bereich befindet sich die zweite Farbe. Sie legt den Bildhintergrund fest. So entstehen ästhetisch teilweise sehr ansprechende Bilder, ohne dass zusätzliche Strukturen sichtbar werden.[5][6][18]
Unter dem Namen Mikropolychromar lieferte Zeiss um 1939 bis nach dem Zweiten Weltkrieg Kondensorzubehör aus, mit dem Rheinbergbeleuchtung möglich war. Eine zentrale Hellfeld- und eine äußere Dunkelfeldbeleuchtung konnten mit Filtern unterschiedlich eingefärbt werden. Zeiss empfahl diese Vorrichtung „zur Erleichterung der Untersuchung ungefärbter Objekte mit geringen Kontrasten“. Gerlach (2009) schrieb über diese Einrichtung sie habe „vor der Einführung des Phasenkontrastverfahrens sicherlich eine gewisse Bedeutung“ gehabt. Die Firma Reichert vertrieb unter dem Namen Optikolor eine Spiegelkondensor-basierte Lösung, die ebenfalls Rheinbergbeleuchtung ermöglichte.[13]
Mit dreifarbigen Rheinbergfiltern lassen sich Präparate besonders effektvoll darstellen, die deutlich strukturiert sind. Der äußere Ring des Filters wird in vier 90°-Winkel aufgeteilt, die jeweils gegenüberliegenden Quadranten werden gleichartig eingefärbt, benachbarte aber in unterschiedlichen Farben. Der innere Kreis wird mit der dritten Farbe eingefärbt. Der zweifarbige äußere Ring bewirkt, dass Strukturen, die von links nach rechts streuen, in einer anderen Farbe dargestellt werden als solche, die in der Präparatebene von vorne nach hinten streuen. Beispiele für solche Präparate sind Diatomeen oder Textilgewebe.[5]
Dunkelfeldbeleuchtung in Auflichtmikroskopen
Klassische Auflicht-Dunkelfeld-Mikroskopie
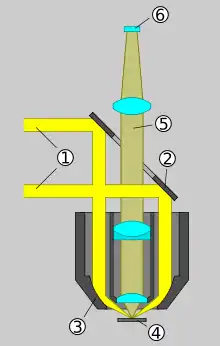
Bei der Auflichtmikroskopie wird das Licht von derselben Seite aus eingestrahlt, von der aus auch beobachtet wird. Dieses Verfahren wird bei lichtundurchlässigen Materialien angewendet, beispielsweise bei Mineralien oder bei Werkstoffprüfungen. Bei Auflicht-Hellfeldbeleuchtung kann die Beleuchtung über den gleichen Objektivstrahlengang eingespeist werden, mit dem auch beobachtet wird.
Bei Auflicht-Dunkelfeldbeleuchtung sind Beleuchtungs- und Beobachtungsstrahlengang dagegen getrennt: Spezialobjektive haben einen zusätzlichen äußeren Bereich, der dem Beleuchtungsstrahlengang vorbehalten ist (siehe Schemazeichnung). Der innere Bereich entspricht einem normalen Objektiv, bei Dunkelfeldbeleuchtung dient er ausschließlich der Beobachtung. Der äußere Bereich entspricht dem Kondensor. Hier wird das Licht (1 in der Zeichnung) durch einen ringförmigen Hohlspiegel im äußeren Bereich (3) schräg auf das Präparat (4) geleitet. Wäre das Präparat ein flacher Spiegel, so würde das dort reflektierte Licht vollständig am inneren Bereich des Objektivs vorbeigeleitet: Das Bild bliebe dunkel. Von Oberflächenstrukturen wie Kratzern abgelenktes Licht wird dagegen vom Objektiv aufgenommen (5).[19][20]
Bei einigen Auflicht-Dunkelfeld-Objektiven ist es möglich, einzelne Sektoren des Beleuchtungsrings ein- oder auszublenden. Dadurch kann eine Schattenbildung verstärkt werden, so dass Strukturen, die in bestimmten Richtungen verlaufen, besser erkannt werden können. Bei sogenannten Ultropak-Beleuchtungseinrichtungen kann der ‚Kondensor‘, der um das Objektiv angebracht ist, in der Höhe verschoben werden, um unterschiedliche Ebenen im Präparat maximal zu beleuchten. Bei geringen Vergrößerungen lässt sich die erforderliche Lichtstärke auch durch eine seitlich aufgestellte externe Lichtquelle erreichen, beispielsweise Faseroptik-Leuchten.[21]
Oberflächenstrukturen wie zum Beispiel Kratzer heben sich im Auflicht-Dunkelfeld deutlich vom Hintergrund ab, da an ihnen reflektiertes oder gestreutes Licht teilweise in den zentralen Bereich des Objektivs gelenkt wird. Derartige Strukturen sind im Bild daher hell auf dunklem Hintergrund. Entsprechend ist Auflicht-Dunkelfeldbeleuchtung besonders geeignet für die Untersuchung von Oberflächen, etwa in den Materialwissenschaften. Dunkelfeldbeleuchtung ist bei Auflichtmikroskopen weit verbreitet. Im Gegensatz zur Durchlicht-Dunkelfeldbeleuchtung kann Auflicht-Dunkelfeldbeleuchtung auch mit den stärksten Objektiven eingesetzt werden. Um unerwünschte Reflexionen zu vermeiden, wird nach Möglichkeit ohne Deckglas gearbeitet.[19][21]
Auflicht-Dunkelfeld in Stereomikroskopen
Bei Stereomikroskopen kann Auflicht-Dunkelfeld realisiert werden, indem die Beleuchtung eher streifend zur Oberfläche erfolgt und das gerichtet reflektierte Licht das Objektiv nicht direkt erreicht. Dies ist zum Beispiel möglich durch leichte Kippung eines flachen Präparats oder eine geschickte Anordnung frei positionierbarer Lichtquellen (z. B. Schwanenhalsbeleuchtung mit einer langen, biegbaren Halterung). Für ringförmige, allseitige Dunkelfeldbeleuchtung gibt es spezielle Ringleuchten mit einem Abstrahlwinkel von beispielsweise 60°, die in einem geringen Abstand von nur 5–15 mm oberhalb der Probe angeordnet sind.[22][23] Der zugehörige Dunkelfeld-Adapter (höhenverstellbarer Tubus) erlaubt eine Montage am Objektiv und vermeidet Streulichteinstrahlung.[24] Ein Beispiel für eine mit einer derartigen Beleuchtung aufgenommenen Probe ist die Abbildung der rechten 2-Euro-Münze im obigen Abschnitt Hell- und Dunkelfeld bei Auflichtbeleuchtung. Bei Stereomikroskopen wird Auflicht-Dunkelfeldbeleuchtung teilweise als Standardbeleuchtungsart gesehen.[25]
Bei gering reflektierenden Objekten entsteht durch die Dunkelfeldabbildung je nach Einfallswinkel eine mehr oder weniger plastische Darstellung.[25] Extreme Dunkelfeldbedingungen lassen sich mit einem Linienlicht realisieren, das ein Lichtband erzeugt, das unter einem extrem flachen Beleuchtungswinkel von einer Seite über die Oberfläche streift. Durch die Schattenbildung entstehen sehr kontrastreiche Aufnahmen selbst von geringen Höhenunterschieden. Fingerabdrücke lassen sich so einfach auf flachen, ebenen Oberflächen darstellen.[24]
Sidestream Dark Field Imaging


Als sidestream dark field imaging (abgekürzt SDF, zu deutsch: Seitenstrom-Dunkelfeld-Bildgebung) wird ein Verfahren zur Untersuchung der Mikrozirkulation bezeichnet, also zur Untersuchung kleiner und kleinster Blutgefäße. Das Verfahren wird mit einem kleinen Gerät durchgeführt, mit dem solche Gefäße bei Patienten zum Beispiel unter der Zunge untersucht werden können, wo keine störenden Hautschichten vorhanden sind. Die Technik verwendet einen zentralen Lichtleiter, in dem eine Linse das Bild des Präparats auf einen Kamerachip projiziert. Aus einem Ring um den zentralen Lichtleiter herum wird das Licht von grünen Leuchtdioden (Wellenlänge 530 nm) auf das Präparat eingestrahlt.[26][27]
Durch die Streuung im Präparat kommt es zu einer gleichmäßigen Verteilung des Lichts im beobachteten Bereich, so dass eine Art Hintergrundbeleuchtung entsteht. Das Hämoglobin in den roten Blutkörperchen absorbiert grünes Licht sehr stark, so dass sich die Blutgefäße, die dicht mit roten Blutkörperchen gefüllt sind, als dunkle Strukturen vor einem erhellten Hintergrund abheben. Die maximale Eindringtiefe ins Gewebe liegt bei 500 Mikrometern.[26][27]
Nachweis submikroskopischer Teilchen
Optische Grundlagen

Die Stärke eines Signals ist bei der Dunkelfeldmikroskopie nicht von der Größe einer Struktur abhängig, sondern davon wie stark das Licht von ihr abgelenkt wird. Daher können mit ihr, ähnlich wie mit der Fluoreszenzmikroskopie, auch manche Partikel oder Strukturen nachgewiesen werden, die kleiner sind als die Auflösungsgrenze des jeweiligen Mikroskops. Allerdings kann dann nicht unterschieden werden, ob das Signal von nur einer oder mehreren, dicht beieinander liegenden Strukturen kommt. Auch entsteht kein Abbild, sondern eine als Punktspreizfunktion bezeichnete Beugungserscheinung, deren Größe wiederum von der Auflösung des Mikroskops abhängt.[6]
Die Form der Teilchen (rund, länglich, kantig …) spielt für die Form und Größe der erzeugten Beugungserscheinung keine Rolle, so dass die Form der Teilchen nicht feststellbar ist. Für kleinere Teilchen nimmt allerdings die Intensität ab, da an ihnen weniger Licht abgelenkt wird. Daher ist für diese eine starke Beleuchtung erforderlich. Die Intensität ist auch abhängig vom Unterschied in der optischen Dichte (Brechungsindex) zwischen Struktur und umgebenden Medium, da bei größeren Brechungsindexunterschieden mehr Licht abgelenkt wird.[6]
Beispiele
Dunkelfeldbeleuchtung wird im Rahmen des Millikan-Versuchs genutzt, bei dem die Dunkelfeldtechnik die Beobachtung von Öltröpfchen in einem Kondensator ermöglicht.[28] Für die Bestimmung der Elementarladung eines Elektrons durch dieses Experiment erhielt Robert Andrews Millikan im Jahr 1923 den Nobelpreis für Physik.
Auch zum Nachweis von Metallpartikeln in Gewebeschnitten kann die Dunkelfeldmikroskopie genutzt werden[29] (siehe auch Abbildung).
Ultramikroskopie
Um das Jahr 1900 herum kam der Begriff „Ultramikroskopie“ auf, mit dem die dunkelfeldmikroskopische Untersuchung sogenannter „Ultramikronen“ bezeichnet wurde, Partikel kleiner als die Auflösungsgrenze des Lichts, also kleiner als 0,2 Mikrometer.[13] Die minimale Größe solcher Partikel, die man bereits 1902 mit hellem Sonnenlicht in Goldrubingläsern mit Hilfe des Ultramikroskops bestimmte, liegt bei unter vier Nanometern.[30]
Das von Henry Siedentopf und Richard Zsigmondy entwickelte Spaltultramikroskop wurde für die Untersuchung von Kolloiden eingesetzt, für biomedizinische Untersuchungen war es nicht geeignet. Die Beleuchtung erfolgte in Form einer Ebene, die seitlich in das Präparat eingekoppelt wurde, ähnlich wie bei der moderneren Technik der Lichtscheiben-Mikroskopie (SPIM), bei der Laser verwendet werden und auch Fluoreszenz angeregt werden kann. Zur Erzeugung der Ebene wurde beim Ultramikroskop ein Spalt vor der Beleuchtungsquelle platziert, dessen Kanten nur einige Hundertstel Millimeter auseinander lagen. Dieser Spalt wurde durch ein Linsensystem etwa 50-fach verkleinert und schließlich ins Präparat abgebildet. Die Firma Zeiss bot Spaltultramikroskope inklusive Zubehör 1910 für 474,50 Mark (für Kolloide in Flüssigkeiten) beziehungsweise 744,50 Mark (Kolloide in festen Materialien) an.[13][31] Um besonders Nanopartikel in Flüssigkeiten beobachten und deren Verhalten studieren zu können entwickelte Richard Zsigmondy das Spaltultramikroskop in Göttingen zusammen mit der Firma R. Winkel GmbH weiter und stellte 1912 das Immersionsultramikroskop vor.[32]
Beim 1903 entwickelten, vereinfachten Ultramikroskop von Cotton und Mouton kam eine völlig andere Beleuchtungsgeometrie zum Einsatz. Ein Lichtkegel wurde seitlich in ein Glas-Prisma mit Parallelogramm-Seitenflächen eingespeist. An der Unterseite des Glaskörpers entstand Totalreflexion, wodurch das Licht zum Präparat geleitet wurde. Der Objektträger wurde mit Immersion direkt auf den Glaskörper gelegt. Die Lichtstrahlen trafen nun so schräg auf das Präparat, dass an der Oberkante des Deckglases ebenfalls Totalreflexion hervorgerufen wurde und kein direktes Licht auf das Objektiv traf. Nur im Präparat gebeugtes Licht wurde aufgenommen. Dieser Aufbau konnte nicht mit Immersionsobjektiven verwendet werden, da sonst am Deckglas keine Totalreflexion stattfand.[13]
Weitere Anwendungen


Auf Grund der im Vergleich zu anderen Kontrastverstärkungsverfahren wie Phasenkontrast oder Differentialinterferenzkontrast limitierten Auflösung der Dunkelfeldmikroskopie ist sie heute nicht mehr so stark verbreitet und nur für einige spezielle Anwendungen von Bedeutung.[33]
Beispielsweise wird sie nach wie vor für den mikroskopischen Nachweis einiger Krankheitserreger in der klinischen Mikrobiologie genutzt, etwa Spirochaeten. Die Fähigkeit submikroskopische Strukturen zu detektieren, kann verwendet werden um isolierte Organellen und Polymere wie Flagellen, Cilien, Mikrotubuli und Aktinfilamente zu untersuchen.[34]
In der Halbleiterindustrie wird Auflicht-Dunkelfeldmikroskopie bei der Oberflächenkontrolle von Wafern eingesetzt, um Schmutzpartikel aufzufinden. Derartige Untersuchungen werden mit Trockenobjektiven (also ohne Immersion) durchgeführt, die Auflösungsgrenze liegt hier bei etwa 0,35 Mikrometern. Dank Dunkelfeldbeleuchtung werden aber auch Partikel sichtbar, die diese Grenze unterschreiten.[35]
In der Metallografie werden die meisten Schliffuntersuchungen im Hellfeld durchgeführt. Daneben kann Dunkelfeld vorteilhaft eingesetzt werden, um mechanische Oberflächenstörungen (Kratzer, Risse, Einschlüsse, Poren, Lunker oder Ausbrüche) zu visualisieren und um an geätzten Schliffen Korngrenzen zu untersuchen.[36] Farben von Einschlüssen (Sulfide oder Oxide) erscheinen im Dunkelfeld deutlicher als im Hellfeld, so dass Zuordnungen einfacher sind.[37]
Auf Grund der ästhetisch ansprechenden Bilder hat die Dunkelfeldmikroskopie bei Hobbymikroskopikern eine gewisse Verbreitung. Mit ihr lassen sich zum Beispiel durchsichtige Wasserkleinstlebewesen (Plankton) beobachten.
Alternativmedizin
Die Nutzung der Dunkelfeldmikroskopie in der Alternativmedizin als Diagnoseverfahren bei Blutuntersuchung soll eine Vielzahl von Erkrankungen erkennen.[38] Häufig folgt der Verkauf von Nahrungsergänzungsmitteln und anderer Therapeutika, um angeblich diagnostizierte Krankheiten zu behandeln. Die Diagnosetechnik basiert auf der Annahme, dass bestimmte Krankheiten sichtbare Phänomene von frischem Blut (zum Beispiel eine Erythrozyten-Aggregation) hervorrufen. Die Methode ist weder plausibel noch eine verlässliche diagnostische Methode, es werden falschpositive oder -negative Diagnosen getroffen.[38]
Nach Günther Enderlein (Isopathie) soll die Dunkelfeldmikroskopie eine Krebsfrüherkennung ermöglichen. Das Verfahren beruht auf wissenschaftlich nicht haltbaren Annahmen zur Morphologie von Mikroorganismen (sogenannter Pleomorphismus). Eine wissenschaftliche Studie kam im Jahr 2005 zu dem Schluss, dass die Dunkelfeldmikroskopie zur Erkennung von Krebs ungeeignet sei.[39]
Ein weiterer alternativmedizinischer Bluttest, der mittels Dunkelfeldmikroskopie durchgeführt wird, ist die Dunkelfeldblutdiagnostik nach von Brehmer. Diese geht auf den Pharmazeuten Wilhelm von Brehmer zurück und soll ebenfalls eine Früherkennung von Krebserkrankungen ermöglichen. Ein Nachweis der Eignung fehlt jedoch. Bei diesem Bluttest wird nach Propionibacterium acnes (alias Siphonospora p.) gesucht, der ein typischer Bestandteil der Hautflora ist, und im Rahmen der Blutabnahme leicht den Ausstrich verkeimen kann.
Weblinks
- Christian Linkenheld: Dunkelfeld-Mikroskopie mit der Zentralblenden-Methode. und Dunkelfeldmikroskopie mit speziellen Dunkelfeld-Kondensoren. mikroskopie.de, 2002; abgerufen am 14. Mai 2012.
- Paraboloid-Kondensor und Kardioid-Kondensor von Zeiss im Museum optischer Instrumente.
- Dunkelfeldbeleuchtung in den Materialwissenschaften, eine Übersicht über Beleuchtungstechniken an der Universität Siegen.
- Immersionsultramikroskop nach R. Zsigmondy mit 1912 patentierten Optiken
Einzelnachweise
- D. Gerlach: Lichtmikroskopie. S. 13–85. In: Horst Robenek (Hrsg.): Mikroskopie in Forschung und Praxis. GIT-Verlag, Darmstadt 1995, ISBN 3-928865-18-8, S. 48, 65.
- A. Ehringhaus: Das Mikroskop seine wissenschaftlichen Grundlagen und seine Anwendung. 2. Auflage. Verlag B. G. Teubner, Leipzig und Berlin 1938, S. 95–109.
- Sophie Perrot: Beleuchtung ist das A und O!, Auswahl der geeigneten Beleuchtung für Anwendungen in der industriellen Bildverarbeitung. In: Optik & Photonik. Band 3. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2010, S. 51–55 (wiley-vch.de [PDF]).
- Oleg Kolosov and Kazushi Yamanaka: Adjustable Acoustic Knife Edge for Anisotropic and Dark-Field Acoustic Imaging. In: Jpn. J. Appl. Phys. Band 33, 1994, S. 329–333, doi:10.1143/JJAP.33.329.
- Randy O. Wayne: Light and Video Microscopy. Academic Press, Elesevier, 2009, ISBN 978-0-12-374234-6, S. 95–98 (englisch).
- Dieter Gerlach: Das Lichtmikroskop. Eine Einführung in Funktion, Handhabung und Spezialverfahren für Mediziner und Biologen. Georg Thieme Verlag, Stuttgart 1976, ISBN 3-13-530301-2, S. 119–126.
- Horst Riesenberg: Optisches System des Mikroskops in: Hermann Beyer, Horst Riesenberg (Hrsg.): Handbuch der Mikroskopie. 3. Auflage. VEB Verlag Technik, Berlin 1988, ISBN 3-341-00283-9, S. 24–107. Seite 107
- Savile Bradbury, Peter Evennett: Contrast techniques in light microscopy. Hrsg.: Royal Microscopical Society, Microscopy Handbooks. BIOS Scientific Publishers, 1996, ISBN 1-85996-085-5, S. 32–33 (englisch).
- Heinz Appelt: Einführung in die mikrosckopischen Untersuchungsmethoden. 4. Auflage. Akademische Verlagsgesellschaft Geest & Portig KG, Leipzig 1959, S. 106 f.
- Website Nikon Microscopy U, Stereomicroscopy: Darkfield illumination.
- J. B. Reade: A New Method of Illuminating Microscopic Objects. In: C. R. Goring, Andrew Pritchard (Hrsg.): Micrographia: containing practical essays on reflecting, solar, oxy-hydrogen gas microscopes; micrometers; eye-pieces, &c. &c. 1837, Appendix 2, S. 227–231 (eingeschränkte Vorschau in der Google-Buchsuche).
- John Thomas Queckett: A Practical treatise on the use of the microscope. 2. Auflage. H. Bailliere Publisher, London 1852, S. 194 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieter Gerlach: Geschichte der Mikroskopie. Verlag Harri Deutsch, Frankfurt am Main 2009, ISBN 978-3-8171-1781-9, S. 663–676.
- Henry Siedentopf: Die Vorgeschichte der Spiegelkondensoren. In: Zeitschrift für wissenschaftliche Mikroskopie. Band 24, 1907, S. 382–395 (biodiversitylibrary.org).
- F. H. Wenham: On a Method of Illuminating Opaque Objects under the Highest Powers of the Microscope. In: The transactions of the Microscopical Society of London. Band 4, 1856, S. 55–60 (eingeschränkte Vorschau in der Google-Buchsuche).
- Henry Siedentopf: Paraboloid-Kondensor, eine neue Methode für Dunkelfeldbeleuchtung zur Sichtbarmachung und zur Moment-Mikrophotographie lebender Bakterien etc. (insbesondere auch für Spriochaete pallida). In: Zeitschrift für wissenschaftliche Mikroskopie. Band 24, 1907, S. 104–108 (biodiversitylibrary.org).
- Hubert de Martin, Waltraud de Martin: Vier Jahrhunderte Mikroskop. Weilburg Verlag, Wiener Neustadt 1983, ISBN 3-900100-06-3, S. 134.
- Mortimer Abramowitz, Michael W. Davidson: Rheinberg Illumination. In: Molecular Expressions - Optical Primer. Florida State University, abgerufen am 17. Mai 2012 (englisch).
- Rainer Wegerhoff, Olaf Weidlich, Manfred Kässens: Contrast and Microscopy. In: Basics of Light Microscopy & Imaging. Special edition of Imaging & Microscopy in Collaboration with Olympus. 2. Auflage. 2011, S. 22–33 (download).
- H. G. Kapitza: Mikroskopieren von Anfang an. 2. überarbeitete Auflage. Carl Zeiss Jena GmbH, 1997, S. 32 (Download Seite).
- Dieter Gerlach: Das Lichtmikroskop. Eine Einführung in Funktion, Handhabung und Spezialverfahren für Mediziner und Biologen. Georg Thieme Verlag, Stuttgart 1976, ISBN 3-13-530301-2, S. 220 f.
- Prospekt der Firma Zeiss Stemi DR, Stemi DV4, Stemi 2000 Stereomikroskope (PDF) abgerufen am 8. Juli 2012
- Ehlert & Partner: LED-Beleuchtung für die Stereomikroskopie, abgerufen am 8. Juli 2012
- Prospekt der Firma Zeiss: Kaltlichtquellen KL1500 LCD und KL 2500 LCD (PDF) abgerufen am 8. Juli 2012
- R. Gieseler: Stereomikroskopie. In: Horst Robenek (Hrsg.): Mikroskopie in Forschung und Praxis. GIT-Verlag, Darmstadt 1995, ISBN 3-928865-18-8, S. 87–127, hier S. 109.
- P. W. Elbers, C. Ince: Mechanisms of critical illness–classifying microcirculatory flow abnormalities in distributive shock. In: Critical care. Band 10, Nummer 4, 2006, ISSN 1466-609X, S. 221. doi:10.1186/cc4969, PMID 16879732, PMC 1750971 (freier Volltext), (Review).
- C. M. Treu, O. Lupi, D. A. Bottino, E. Bouskela: Sidestream dark field imaging: the evolution of real-time visualization of cutaneous microcirculation and its potential application in dermatology. In: Archives of dermatological research. Band 303, Nummer 2, März 2011, ISSN 1432-069X, S. 69 ff., doi:10.1007/s00403-010-1087-7, PMID 20972572 (Review).
- Robert Andrews Millikan: The Isolation of an Ion, a Precision Measurement of its Charge, and the Correction of Stokes’s Law. In: Physical Review (Series I). Band 32, Nr. 4, 1911, S. 349–397, doi:10.1103/PhysRevSeriesI.32.349.
- Nachweis anorganischer Substanzen: 8. Allgemeiner Nachweis von Metallen. In: Benno Romeis, Peter Böck (Hrsg.): Mikroskopische Technik. 17. Auflage. Urban & Schwarzenberg, München/Wien/Baltimore 1989, ISBN 3-541-11227-1, S. 429.
- H. Siedentopf, R. Zsigmondy: Über Sichtbarmachung und Größenbestimmung ultramikroskopischer Teilchen, mit besonderer Anwendung auf Goldrubingläser. In: Annalen der Physik. Band 315, 1902, S. 1–39, doi:10.1002/andp.19023150102.
- W. Gebhardt: Aus optischen und mechanischen Werkstätten I. In: Zeitschrift für wissenschaftliche Mikroskopie. Band 24, Nr. 4, 1907, S. 396–421 (biodiversitylibrary.org).
- Timo Mappes, Norbert Jahr, Andrea Csáki, Nadine Vogler, Jürgen Popp, Wolfgang Fritzsche: Die Erfindung des Immersions-Ultramikroskops 1912 – Beginn der Nanotechnologie? In: Angewandte Chemie. Band 124, Nr. 45, 2012, S. 11307–11375, doi:10.1002/ange.201204688.
- Rainer Wegerhoff, Manfred Kässens, Rudolph Reimer: Mikroskopische Verfahren. In: Maria Mulisch, Ulrich Welsch (Hrsg.): Romeis - Mikroskopische Technik. 19. Auflage. Springer, 2015, ISBN 978-3-642-55189-5, S. 12, doi:10.1007/978-3-642-55190-1.
- Douglas B. Murphy: Fundamentals of Light Microscopy and Electronic Imaging. Wiley-Liss, New York 2001, ISBN 0-471-25391-X, S. 112–115 (englisch).
- Jan Albers: Kontaminationen in der Mikrostrukturierung. 1. Auflage. Hanser Verlag, 2005, ISBN 3-446-40291-8, S. 110–113 (eingeschränkte Vorschau in der Google-Buchsuche).
- Praktikum IV: Metallographie Lichtmikroskopie. (Memento vom 22. Januar 2016 im Internet Archive) (PDF; 5,5 MB) ETH Zürich; abgerufen am 8. Juli 2012.
- Die Summe unserer Erfahrung: Ein Leitfaden zur Präparation von Werkstoffen und deren Auswertung. (Memento vom 20. Januar 2013 im Internet Archive) (PDF; 5,0 MB) Buehler; abgerufen am 8. Juli 2012
- Edzard Ernst: Heilung oder Humbug?: 150 alternativmedizinische Verfahren von Akupunktur bis Yoga. 1. Auflage. Springer, Berlin 2020, ISBN 978-3-662-61708-3, S. 80–81, doi:10.1007/978-3-662-61709-0.
- Samer El-Safadi et al.: Erlaubt die Dunkelfeldmikroskopie nach Enderlein die Diagnose von Krebs? Eine prospektive Studie. In: Forschende Komplementarmedizin und Klassische Naturheilkunde/Research in Complementary and Classical Natural Medicine. Band 12, 2005, S. 148–151, doi:10.1159/000085212.