Downs-Zelle
Die Downs-Zelle ist eine Elektrolysezelle zur Darstellung von metallischem Natrium und von Chlor. In ihr wird bei etwa 600 °C das geschmolzene Natriumchlorid elektrolysiert, wobei zur Erniedrigung des Schmelzpunkts Calciumchlorid zugesetzt wird.[1] Die Downs-Zelle wurde von James Cloyd Downs erfunden, der 1924 ein Patent darauf erhielt.[2][3]
Das Elektrolyseverfahren, die Schmelzflusselektrolyse von Natriumchlorid, wird dementsprechend Downs-Prozess genannt. Magnesium kann ebenfalls mit diesem Verfahren aus Magnesiumchlorid gewonnen werden.
Aufbau
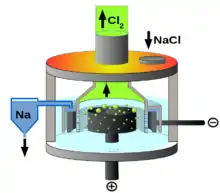
Entscheidend für den Aufbau einer für die Kochsalzelektrolyse geeigneten Zelle ist die geringere Dichte der Reaktionsprodukte Chlor und Natrium: das Chlorgas entweicht, das flüssige Natrium steigt zur Oberfläche und schwimmt auf der Schmelze. Um zu verhindern, dass Natrium und Chlor miteinander reagieren, müssen sie auseinandergehalten werden. Daher werden Kathode und Anode durch ein Netz getrennt, das die Vermischung minimiert und trotzdem einen Stromdurchgang gestattet. Typische Bedingungen sind Spannungen von 7 bis 8 V und Stromstärken von 25 bis 40 kA.[4]
Die Kathode besteht aus einem Eisenring, die Anode aus einem Kohlenstoffblock. Typisch für die Downs-Zelle ist, dass sich die Anode innerhalb der ringförmigen Kathode befindet.[5]
Das abfließende Natrium enthält etwas Calciumchlorid und wird daher filtriert, um dieses abzutrennen. Ansonsten ist das gewonnene Metall relativ rein.
Die Zelle könnte im Prinzip auch mit offenem Schmelzbehälter betrieben werden, da die bloße Salzschmelze nicht reaktiv ist, solange die Produkte wie gewünscht in ihre abgetrennten Bereiche steigen. Zur Vermeidung von Wärmeverlusten wird aber ein geschlossenes Gefäß verwendet, das oben eine Öffnung zur Zuführung von NaCl hat.
Reaktionsgleichungen
An der positiv geladenen Anode spielt sich folgende Reaktion ab:
- Zwei Chloridionen werden zu elementarem Chlor oxidiert.
An der negativ geladenen Kathode findet folgende Reaktion statt:
- Zwei Natriumionen werden zu elementarem Natrium reduziert.
Die gesamte Redoxreaktion sieht wie folgt aus:
Die theoretische Zersetzungsspannung für diese Reaktion in geschmolzenem NaCl bei 600 °C ist 3,424 V.[6]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 932–933.
- Patent US1501756: Electrolytic process and cell. Angemeldet am 18. August 1922, veröffentlicht am 15. Juli 1924, Anmelder: Roessler & Hasslacher Chemical Company, Erfinder: James Cloyd Downs.
- Patent CA275511: Electrolytic process and cell/ Procede et case electrolytiques. Veröffentlicht am 15. November 1927, Anmelder: The Roessler and Hasslacher Chemical Company, Erfinder: James Cloyd Downs.
- Sodium Production by Electrowinning. Corrosion Doctors, Pierre R. Roberge, abgerufen am 3. Juni 2015.
- Hem Shanker Ray: Introduction to Melts: Molten Salts, Slags and Glasses. Hrsg.: Sunil Sachdev. Allied Publishers, Mumbai, New Delhi 2006, ISBN 81-7764-875-6.
- Walter J. Hamer, Marjorie S. Malmberg, Bernard Rubin: Theoretical Electromotive Forces for Cells Containing a Single Solid or Molten Chloride Electrolyte. In: Journal of The Electrochemical Society. Band 103, Nr. 1, 1956, S. 8–16, doi:10.1149/1.2430236.