Doppelschichtkapazität
Eine Doppelschichtkapazität entsteht nach dem Anlegen einer elektrischen Spannung durch Ladungstrennung in einer Helmholtz-Doppelschicht an der Phasengrenze zwischen Elektrodenoberfläche und Elektrolyt.[1] Die elektrische Energie in der Doppelschichtkapazität wird statisch in einem elektrischen Feld gespeichert.

Untrennbar zusammen mit einer statischen Doppelschichtkapazität tritt in diesen elektrochemischen Kondensatoren mit der sogenannten Pseudokapazität aber immer auch noch eine elektrochemische Speicherung der elektrischen Energie auf.[2][3]
Realisiert und verwendet wird die Doppelschichtkapazität in Superkondensatoren, auch „Doppelschichtkondensatoren“ genannt.
Historie
Zur Historie der theoretischen Modelle zum Doppelschicht-Phänomen siehe Elektrochemische Doppelschicht.
Zur Historie der Entwicklung der elektrochemischen Kondensatoren siehe Superkondensator.
Funktionsweise

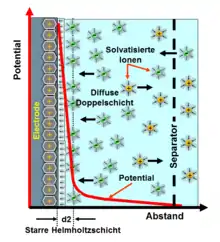
Mit der Beschreibung der elektrischen Phänomene an den Grenzflächen zwischen metallischer oder metallisch leitender Elektrode und einem flüssigen Elektrolyten beschrieb Helmholtz erstmals den „Doppelschichteffekt“. Bei diesem elektrischen Phänomen an der Phasengrenze zwischen der Oberfläche der Elektrode und dem Elektrolyten entstehen durch Anlegen einer Spannung zwei ionisierte Schichten, eine im Oberflächenbereich der metallisch leitenden Elektrode und eine zweite Schicht entgegengesetzter Polarität im anliegenden Bereich des flüssigen Elektrolyten bestehend aus dissoziierten und solvatisierten Ionen. Diese beiden Schichten ionisierter elektrischer Ladungen werden getrennt durch eine monomolekulare Lage aus polaren Molekülen des Elektrolyt-Lösungsmittels, d. h. bei wässrigen Elektrolyten aus Wassermolekülen, die durch physikalische Adsorption fest an der Oberfläche der Elektrode haften und elektrisch isolierend wirken. Sie bilden die „Innere Helmholtz-Schicht (IHP)“, die ähnlich wie das Dielektrikum in einem konventionellen Kondensator ladungstrennende Wirkung hat.[1]
Die Adsorption ist ein physikalischer Prozess, bei dem ein Stoff, in diesem Fall die Moleküle des Lösungsmittels, auf der Oberfläche eines anderen Stoffes, hier die Elektrode, haften bleiben und sich auf dessen Oberfläche anreichern. Die Kräfte, die die Anhaftung verursachen, sind keine chemischen Bindungen, sondern physikalische Kräfte ähnlich der Adhäsion. Chemische Bindungen innerhalb der adsorbierten Moleküle bleiben bestehen, sie werden jedoch polarisiert.
Die Ladungsmenge, d. h. die Anzahl der Ionen, die aus dem Elektrolyten kommend sich durch Anreicherung in einer Doppelschicht ansammeln kann, ist abhängig von der Konzentration der Ionen im Elektrolyten und der Oberfläche der Elektrode. Sie ist bis zu einem Grenzwert, der sog. Zersetzungsspannung des Elektrolyten, linear abhängig von der angelegten Spannung. Die Anzahl der Ladungsträger in der Elektrode werden durch eine entsprechende Anzahl von Ionen entgegengesetzter Polarität, den Gegenionen, im Elektrolyten ausgeglichen. Zwischen den Ladungsträgern bildet sich ein statisches elektrisches Feld aus, das die zwischenliegenden Lösungsmittelmoleküle polarisiert. Diese Ladungstrennung in der Doppelschicht bewirkt die Speicherung elektrischer Energie.
Die „Dicke“ einer geladenen elektrochemischen Doppelschicht, d. h. die mittlere Ausdehnung senkrecht zur Oberfläche, beträgt in der metallischen Elektrode etwa 0,1 nm. Sie hängt hauptsächlich von der Elektronendichte ab, da die Atomrümpfe in festen Elektroden nicht beweglich sind. Im Elektrolyten ist sie abhängig von der Größe der Moleküle des Lösungsmittels und von der Beweglichkeit und Konzentration der Ionen im Lösungsmittel. Sie beträgt im Elektrolyten etwa 0,1 bis 10 nm und wird durch die Debye-Länge beschrieben. Beide „Dicken“ ergeben zusammen die Gesamtdicke einer Doppelschicht.
Die Helmholtz-Doppelschicht in einem Doppelschichtkondensator ist wirksam wie ein Plattenkondensator mit dem Abstand der Dicke eines Lösungsmittelmoleküls. Die Kapazität einer Doppelschicht berechnet sich nach der Formel des Plattenkondensators.
Das bedeutet, die Kapazität C eines Kondensators ist umso größer, je größer die Elektrodenfläche A und die Permittivität ε ist und je dünner das Dielektrikum d ist. Die hoch-aufgeraute sehr große Oberfläche der Elektroden dieser Kondensatoren und die äußerst dünne innere Helmholtz-Schicht in der Größenordnung von einigen Nanometern bewirken zusammen die sehr große Doppelschichtkapazität.[2][4]
Durch die äußerst geringe Dicke der Helmholtz-Doppelschicht entsteht in ihr ein sehr starkes elektrisches Feld E. Bei einer Potentialdifferenz von beispielsweise U = 2 V und einem molekularen Abstand von d = 0,4 nm beträgt die elektrische Feldstärke
Um diesen Wert einordnen zu können, sei hier ein Vergleich mit einem Aluminium-Elektrolytkondensator gegeben. Die Spannungsfestigkeit der Aluminiumoxidschicht beträgt etwa 1,4 nm/V. Bei einem 6,3 V-Kondensator ist die Dicke des Dielektrikums dann also etwa 8,8 nm. Daraus berechnet sich die Feldstärke im Aluminiumoxid mit 6,3 V/8,8 nm = etwa 0,7 V/nm.

Eine Feldstärke von 5 V/nm, die in den Molekülen in der inneren Helmholtz-Schicht auftritt, ist in einem Kondensator mit einem herkömmlichen Dielektrikum nicht realisierbar. Kein Dielektrikum könnte einen Durchbruch der Ladungsträger verhindern. In einer Doppelschicht verhindert die chemische Stabilität der molekularen Bindung des trennenden Lösungsmittelmoleküls einen Durchschlag.[5] Allerdings hat die extrem starke Feldstärke einen großen Einfluss auf die Permittivität des Materials, aus dem die trennende innere Helmholtz-Schicht gebildet wird. Beispielsweise liegt die Permittivität des Wassers normalerweise bei 80. Sie verringert sich unter dem Einfluss der extrem großen Feldstärke auf einen Wert von etwa 6.[6][7]
Jeder Doppelschichtkondensator hat nun zwei Elektroden, die durch einen Separator gegen mechanische Berührungen geschützt sind. Der Elektrolyt, durchsetzt mit seinen positiven und negativen Ionen, die den Elektrolyten leitfähig machen, verbindet die beiden Elektroden miteinander. Nach dem Anlegen einer Spannung bildet sich an jeder der beiden Elektroden eine Doppelschicht aus. Die anliegende Spannung bewirkt eine Wanderung der statistisch im Elektrolyten verteilten gelösten Ionen zur jeweils gegenpoligen Elektrode. Dort bilden sie mit den Ionen in der Elektrode eine Doppelschicht, getrennt durch die Lage der Lösungsmittelmoleküle. Die Ladungsverteilung an der einen Elektrode findet sich spiegelbildlich an der zweiten Elektrode des Kondensators wieder. Beide Doppelschichten wirken wie zwei in Serie geschaltete Kondensatoren. Bei symmetrisch aufgebauten Kondensatoren, bei denen beide Elektroden in etwa eine gleich große Kapazität aufweisen, ist also die Gesamtkapazität des Kondensators gleich dem halben Wert einer Elektrode.
Nach einem Abschalten der Spannung verteilen sich die Ionen wieder statistisch im Elektrolyten.
Die elektrisch trennende Wirkung einer Helmholtz-Doppelschicht ist, abhängig vom Elektrolytsystem, nur für einen relativ kleinen Spannungsbereich von etwa 1,2 bis 3 V wirksam. Steigt die Spannung über die Zersetzungsspannung des Elektrolyten hinaus (siehe auch Elektrolyse), dann bricht die trennende Wirkung der Helmholtz-Doppelschicht zusammen und es entsteht ein Kurzschluss.
Einzelnachweise
- Zbigniew Stojek: The Electrical Double Layer and Its Structure. In: Fritz Scholz (Hrsg.): Electroanalytical Methods: Guide to Experiments and Applications. Springer, Berlin/Heidelberg 2010, ISBN 978-3-642-02914-1, S. 3–10 (englisch, http://www.scribd.com/doc/23724566/The-Electrical-Double-Layer-and-Its-Structure online).
- Marin S. Halper, James C. Ellenbogen: Supercapacitors: A Brief Overview. (PDF) In: MITRE Nanosystems Group. März 2006, archiviert vom (nicht mehr online verfügbar) am 20. März 2013; abgerufen am 14. Mai 2013 (englisch). Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.(zuletzt abgerufen am 27. Juli 2013)
- E. Frackowiak, F. Beguin: Carbon Materials For The Electrochemical Storage Of Energy In Capacitors. In: CARBON. Band 39, 2001, S. 937–950 (PDF) und E. Frackowiak, K. Jurewicz, S. Delpeux, F. Béguin: Nanotubular Materials For Supercapacitors. In: Journal of Power Sources. Volumes 97–98, Juli 2001, S. 822–825, doi:10.1016/S0378-7753(01)00736-4.
- Adam Marcus Namisnyk and J. G. Zhu: A Survey of Electrochemical Super-Capacitor Technology. 2003 (psu.edu [PDF; abgerufen am 7. Dezember 2015] Bachelor-Arbeit; University of Technology, Sydney; 2003).
- Daniel Gräser, Christoph Schmid: Supercap, Grundlagen – Eigenschaften – Anwendungen. Berner Fachhochschule, Semesterarbeit in Technologie und Deutsch PDF
- S. Srinivasan, Fuel Cells, From Fundamentals to Applications, Springer eBooks, 2006, ISBN 978-0-387-35402-6, Download CHAPTER 2, ELECTRODE/ELECTROLYTE INTERFACES: STRUCTURE AND KINETICS OF CHARGE TRANSFER (pdf, 769 kB) (zuletzt abgerufen am 30. Juli 2013)
- Stefan Woelki, Theorie der elektrischen Doppelschicht, ISBN 3-89675-568-4, S. 36, Abb. 3-3 Google-Books